COVID-19
Afweer en vaccin
Verschillende vaccinsJohn Jacobs, 28 november 2020. |
Vaccins kunnen op vele verschillende manieren worden gemaakt en hebben andere uitkomsten voor immuniteit. Gezien de (deels onbegrepen) complexiteit van de virusimmuunpathologie, is het goed om te begrijpen hoe vaccins worden gemaakt, welk mechanisme ze hebben en hoe ze worden getest. Het ene vaccin kan veilig en effectief zijn door immunologische bescherming, terwijl het andere zieker maakt.
Productie van afgezwakte virussen en virus voor geïnactiveerde vaccins is volledig afhankelijk van celkweek. Virusvaccins met losse eiwitten of voor DNA-vectoren worden vaak ook in celkweek geproduceerd. De nieuwe mRNA vaccins worden chemisch gesynthetiseerd.
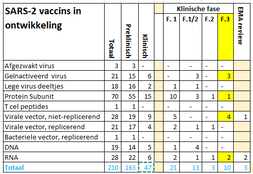
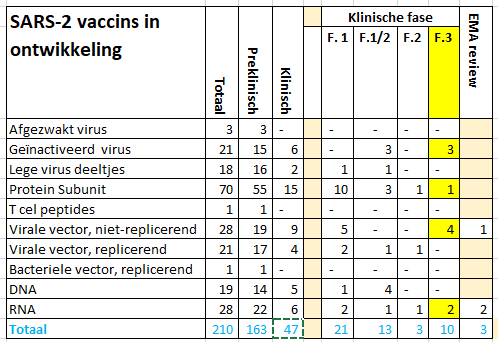
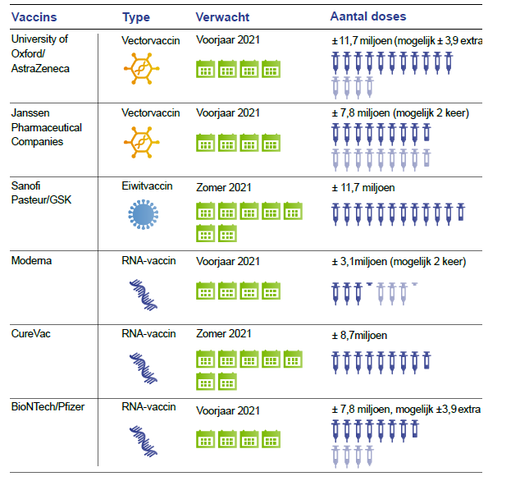
Na het preklinische onderzoek worden vaccins getest op veiligheid (fase 1) en principe van effectiviteit (fase 2) in de mens. Dan volgt de fase 3 studie waarin de effectiviteit en veiligheid na infectie bestudeerd worden. Vervolgens kan een vaccin worden ingediend bij de Europese Geneesmiddelen Autoriteit (EMA) voor registratie. De wereldgezondheidsorganisatie (WHO) gaf op 12.11.2020 een lijst van 210 vaccins in ontwikkeling, 163 in een preklinische fase en 47 in een klinische fase. Tien vaccins zitten in een klinische fase 3 studie die (Figuur 6). Drie van deze zijn ingediend om te worden beoordeeld voor registratie door de EMA. Nederland heeft contracten gesloten met AstraZeneca/Oxford, Janssen Pharmaceutica, Sanofi Pasteur/GSK en BioNTech/Pfizer. Mondelingen afspraken zijn er met Moderna en CureVac. Onderhandelingen zijn gaande met Novavax (Figuur 7).
Grofweg bestaan er drie strategieën voor vaccinontwikkeling, waarvan twee belangrijke varianten hebben. Vaccins kunnen gemaakt zijn van:
Productie van afgezwakte virussen en virus voor geïnactiveerde vaccins is volledig afhankelijk van celkweek. Virusvaccins met losse eiwitten of voor DNA-vectoren worden vaak ook in celkweek geproduceerd. De nieuwe mRNA vaccins worden chemisch gesynthetiseerd.
Na het preklinische onderzoek worden vaccins getest op veiligheid (fase 1) en principe van effectiviteit (fase 2) in de mens. Dan volgt de fase 3 studie waarin de effectiviteit en veiligheid na infectie bestudeerd worden. Vervolgens kan een vaccin worden ingediend bij de Europese Geneesmiddelen Autoriteit (EMA) voor registratie. De wereldgezondheidsorganisatie (WHO) gaf op 12.11.2020 een lijst van 210 vaccins in ontwikkeling, 163 in een preklinische fase en 47 in een klinische fase. Tien vaccins zitten in een klinische fase 3 studie die (Figuur 6). Drie van deze zijn ingediend om te worden beoordeeld voor registratie door de EMA. Nederland heeft contracten gesloten met AstraZeneca/Oxford, Janssen Pharmaceutica, Sanofi Pasteur/GSK en BioNTech/Pfizer. Mondelingen afspraken zijn er met Moderna en CureVac. Onderhandelingen zijn gaande met Novavax (Figuur 7).
Grofweg bestaan er drie strategieën voor vaccinontwikkeling, waarvan twee belangrijke varianten hebben. Vaccins kunnen gemaakt zijn van:
- Afgezwakt virus
- Viruseiwitten
- Geïnactiveerd virus
- Lege virusdeeltjes
- Sub-eenheid
- Peptiden
- Virus genen
- Vectoren
- DNA vaccins
- RNA vaccins
Figuur 6. SARS-2 vaccins in ontwikkeling (WHO)
Figuur 7. Kandidaat vaccins voor Nederland volgens de Gezondheidsraad.
Nederland heeft 17,4 miljoen inwoners en ontvangt 3,9% van de EU vaccins. Andere EU-landen ontvangen eveneens vaccins naar rato van het aantal inwoners.
Nederland heeft 17,4 miljoen inwoners en ontvangt 3,9% van de EU vaccins. Andere EU-landen ontvangen eveneens vaccins naar rato van het aantal inwoners.
Viruskweek
Virussen kunnen alleen groeien in levende cellen. Oorspronkelijk gebeurde dat op delen van het dieren (zoals een rundertong), later werden cellen geïsoleerd omdat dit beter werkte. De volgende grote stap was dat kankercellen gebruikt werden, deze hebben het voordeel dat de kwaliteit en de veiligheid constant is. Daarna kwamen de cellen die zeer gecontroleerd gemaakt zijn, zoals PER.C6, waarbij schadelijke factoren zo goed als kunnen worden uitgesloten. PER.C6 is een cel (uit een geaborteerde foetus) die onsterfelijk is gemaakt met het adenovirus E1 gen.
Afgezwakt virus
Het klassieke voorbeeld hiervan zijn de vaccinia, de koeienpokken, een van nature afgezwakte vorm van pokken. De BMR-prik (bof, mazelen en rodehond) bevat afgezwakte virussen die goede bescherming geven na een milde ziekte. Na een SARS-2 infectie is immuniteit echter kortdurend. Voor SARS-1 is een virus gemaakt zonder Envelop (E-gen). Dat virus kan in celkweek worden gekweekt. Een dergelijk afgezwakt virus zou in theorie kunnen recombineren met het normale virus. Dit lijkt een onwenselijke aanpak voor SARS-2.
In de preklinische fase zitten 3 vaccins met een afgezwakt virus.
In de preklinische fase zitten 3 vaccins met een afgezwakt virus.
Geïnactiveerd virus
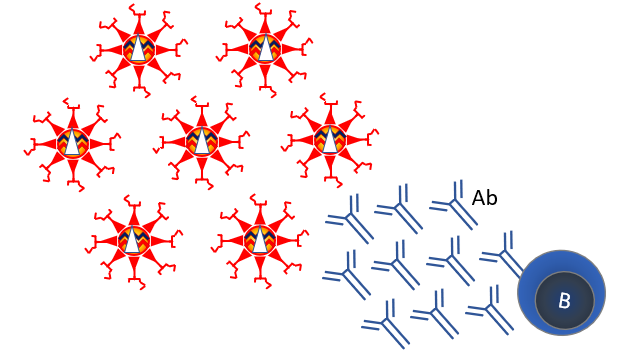
Sinds de jaren 1950 worden virussen gekweekt in celkweek. Chemische behandeling kan dit virus inactiveren, waardoor een onschadelijk vaccin wordt gemaakt. Deze strategie wordt gebruikt voor veel vaccins, zoals het poliovaccin. Geïnactiveerde vaccins wekken vooral goede antistofreacties op (Figuur 5). Traditioneel werd bij vaccins vooral gekeken naar antistoffen want die zijn goed te meten. Bij virusinfecties is het onduidelijk of antistoffen beschermen. Een geïnactiveerd vaccin tegen het verwante SARS-1 leidde na infectie tot antistof-gemedieerde verergering van de ziekte in makaken (zie Figuur 4).
Bharat Biotech (India) en de Chinese producenten Sinovac en Sinopharm (2 vaccins) hebben geïnactiveerde vaccins in klinische fase 3 studies. Het virus voor deze vaccins wordt gekweekt op Vero-cellen, een cellijn die uit niercellen van de groene meerkat is geïsoleerd. Na kweken wordt dit virus geïnactiveerd. Inmiddels hebben bijna 1 miljoen Chinezen het Sinopharm vaccin ontvangen. De registratie is anders dan bij de gerandomiseerde en gecontroleerde studies (RCT’s) in het westen. Een probleem voor deze studie is dat het SARS-2 virus nauwelijks meer besmettingen in China geeft. Sinovac test haar vaccins in fase 3 studies in Chili, Indonesië en Turkije.
Het Bharat vaccin test twee verschillende adjuvantia , de standaard variant voor Th2 responsen en een andere die mogelijk Th1 responsen stimuleert. Bharat test haar BBV152B vaccin in India.
Nederland heeft geen plannen om geïnactiveerde vaccins in te kopen.
Bharat Biotech (India) en de Chinese producenten Sinovac en Sinopharm (2 vaccins) hebben geïnactiveerde vaccins in klinische fase 3 studies. Het virus voor deze vaccins wordt gekweekt op Vero-cellen, een cellijn die uit niercellen van de groene meerkat is geïsoleerd. Na kweken wordt dit virus geïnactiveerd. Inmiddels hebben bijna 1 miljoen Chinezen het Sinopharm vaccin ontvangen. De registratie is anders dan bij de gerandomiseerde en gecontroleerde studies (RCT’s) in het westen. Een probleem voor deze studie is dat het SARS-2 virus nauwelijks meer besmettingen in China geeft. Sinovac test haar vaccins in fase 3 studies in Chili, Indonesië en Turkije.
Het Bharat vaccin test twee verschillende adjuvantia , de standaard variant voor Th2 responsen en een andere die mogelijk Th1 responsen stimuleert. Bharat test haar BBV152B vaccin in India.
Nederland heeft geen plannen om geïnactiveerde vaccins in te kopen.
Figuur 8. Geïnactiveerd vaccin
Lege virusdeeltjes
“Virus-like particles” zijn virusdeeltjes zonder het erfelijk materiaal (DNA of RNA). Ze worden gebruikt om eiwitten van eiwitvaccins dicht bij elkaar te zetten. Deze zijn dan ook niet gemaakt van coronavirussen, maar van andere virussen, zoals plantenvirussen en dienen voor de structuur. In die structuur wordt dan het Spike eiwit ingezet. Enkele bedrijven zijn bezig met vroege klinische studies naar lege virusdeeltjes.
Sub-eenheid
Met de opkomst van recombinant-DNA-technieken is het mogelijk om een specifiek gen te isoleren uit een virus en dat te produceren. Dat gebeurt nu al bij vaccins tegen verschillende bacteriën, zoals pneumokokken-, Hib- en meningokokken en virussen zoals HPV en hepatitis B vaccin.
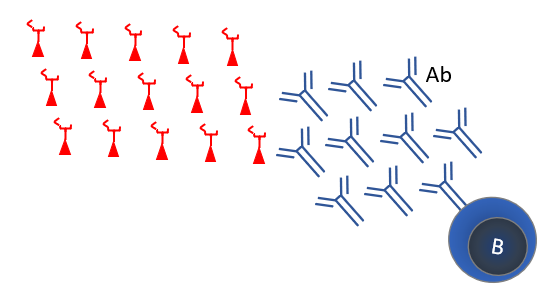
Voor de SARS-2 vaccins wordt vrijwel altijd het Spike (S) eiwit gebruikt, want dat levert sterke neutraliserende antistoffen op (Figuur 7). Het naamloze Sanofi/GSK vaccin is een recombinant Spike-eiwit met adjuvans. Een adjuvans is een stof die de immuunreactie stimuleert. Dit vaccin zit nog in de klinische fase 1/2, waarin men verschillende formuleringen en adjuvantia vergelijkt in 11 verschillende combinaties. Dit is een van de vaccins waar Nederland een optie op heeft mits klinische fase 3 studie goede resultaten geeft.
Novavax is een eiwit vaccin dat een op saponine gebaseerde matrix gebruikt voor versterking van afweerreacties. Saponine adjuvantia sturen de afweerreacties naar een Th1/Th2 balans, dus ook cellulaire afweer, terwijl eiwitvaccins normaal alleen een Th2 respons met antistoffen induceren. Dit vaccin zit in een fase 3 studie. Nederland is overleg met de fabrikant om ook dit vaccin aan te schaffen.
Voor de SARS-2 vaccins wordt vrijwel altijd het Spike (S) eiwit gebruikt, want dat levert sterke neutraliserende antistoffen op (Figuur 7). Het naamloze Sanofi/GSK vaccin is een recombinant Spike-eiwit met adjuvans. Een adjuvans is een stof die de immuunreactie stimuleert. Dit vaccin zit nog in de klinische fase 1/2, waarin men verschillende formuleringen en adjuvantia vergelijkt in 11 verschillende combinaties. Dit is een van de vaccins waar Nederland een optie op heeft mits klinische fase 3 studie goede resultaten geeft.
Novavax is een eiwit vaccin dat een op saponine gebaseerde matrix gebruikt voor versterking van afweerreacties. Saponine adjuvantia sturen de afweerreacties naar een Th1/Th2 balans, dus ook cellulaire afweer, terwijl eiwitvaccins normaal alleen een Th2 respons met antistoffen induceren. Dit vaccin zit in een fase 3 studie. Nederland is overleg met de fabrikant om ook dit vaccin aan te schaffen.
Figuur 9. Recombinant Spike eiwitvaccin levert TH2 en B-cel responsen op.
Peptiden
Peptiden zijn een deel van een eiwit en worden gebruikt door dendritische cellen om afweerreacties aan te zetten in Th en Tc cellen (zie figuur 4). Het onderzoek naar peptidevaccins bevindt zich nog in een vroeg stadium.
Genen voor eiwitten
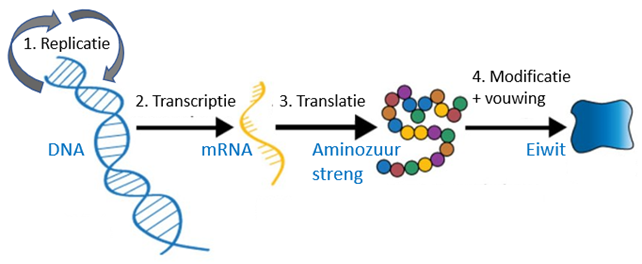
Een nieuwe revolutie in vaccintechnologie is dat vaccins niet meer bestaan uit de eiwitten die de afweerreactie veroorzaken, maar dat deze eiwitten gemaakt worden in de mens na vaccinatie. Deze technologieën schuiven dus naar de bron op in het centrale dogma van de biologie (Figuur 8). Eiwitzuivering en opwerken vraagt complexe technologie. Bij te wilde behandeling aggregeren eiwitten en die aggregaten krijg je niet meer terug in hun oorspronkelijke vorm. Wie een ei kookt of bakt ziet wat er dan gebeurt. Je krijgt het ei niet meer in de oude vloeibare staat. De belangrijkste reden zit echter in de immunologie. Eiwitproductie in een lichaamscel is belangrijk voor cellulaire afweer die mogelijk cruciaal is in de strijd tegen virussen.
Figuur 10. Centrale dogma van de biologie.
(1) DNA kan worden vermenigvuldigd (replicatie). (2) DNA wordt afgelezen (transcriptie) naar mRNA (genetische werkkopie). (3) mRNA wordt vertaald (translatie) naar een aminozuurstreng. (4) Aan die aminozuurstreng gebeuren allerlei chemische reacties zoals het vormen van crosslinks en het toevoegen van fosfaat-, suiker- en lipide (vet) groepen. Tijdens dit proces worden eiwitten gevouwen. Juiste vouwing van eiwitten is cruciaal voor hun functie. Kleine verschillen kunnen hier grote gevolgen hebben, een ziekte als taaislijmziekte is bijvoorbeeld vooral het gevolg van een onjuiste eiwitvouwing (door een kleine mutatie). Eiwitvouwing gaat totaal anders in zoogdiercellen dan in planten of bacteriën. Dit is een ander groot verschil tussen bacteriologie en virologie. Virussen gebruiken zoogdiercellen, terwijl bacteriën zelf hun eiwitten maken.
(1) DNA kan worden vermenigvuldigd (replicatie). (2) DNA wordt afgelezen (transcriptie) naar mRNA (genetische werkkopie). (3) mRNA wordt vertaald (translatie) naar een aminozuurstreng. (4) Aan die aminozuurstreng gebeuren allerlei chemische reacties zoals het vormen van crosslinks en het toevoegen van fosfaat-, suiker- en lipide (vet) groepen. Tijdens dit proces worden eiwitten gevouwen. Juiste vouwing van eiwitten is cruciaal voor hun functie. Kleine verschillen kunnen hier grote gevolgen hebben, een ziekte als taaislijmziekte is bijvoorbeeld vooral het gevolg van een onjuiste eiwitvouwing (door een kleine mutatie). Eiwitvouwing gaat totaal anders in zoogdiercellen dan in planten of bacteriën. Dit is een ander groot verschil tussen bacteriologie en virologie. Virussen gebruiken zoogdiercellen, terwijl bacteriën zelf hun eiwitten maken.
Vectoren
In plaats van eiwitten kan ook het erfelijk materiaal worden ingespoten dat zorgt voor deze eiwitten. Indien DNA-virussen worden gebruikt kunnen deze zichzelf vermenigvuldigen. Het probleem is dat dit wel gewenst is in de celkweek om vaccin te maken, maar niet altijd in de mens die gevaccineerd wordt. De truc die daarop gevonden is twee vectoren maken, de ene die ingepakt wordt in virus-achtige verpakking en de andere die de benodigde eiwitten maakt, maar zelf niet wordt ingepakt. Dat is het onderliggende principe van DNA-vectoren. In al deze vaccins wordt het Spike eiwit van SARS-2 gebruikt.
Wetenschappers selecteerden vectoren gebaseerd op adenovirussen, omdat vaccinatie hiermee leidde tot de meeste neutraliserende antistoffen tegen virussen zoals SARS (Figuur 9). Het adenovirus bevat een aantal genen die kanker kunnen veroorzaken, met name de E1 en E4. Deze genen worden daarom ook uit de vectoren gehaald. Adenovirus-vectoren zijn al een aantal jaren in ontwikkeling voor vaccins tegen tuberculose, malaria en meerdere virussen, zoals Ebola, Zika, influenza en HIV. In vroege klinische studies bleken deze veilig. Een klinische studie naar HIV-vaccinatie is echter destijds afgebroken vanwege gebrek aan veiligheid. De onderzoekers waarschuwen voor een mogelijk verhoogde gevoeligheid voor HIV.
Zoals eerder bediscussieerd, kunnen de hogere antistoftiters door adenovectoren zowel een voordeel als een nadeel zijn voor de werking van dit vaccin vergeleken met mRNA vaccins. Klinisch onderzoek zal moeten uitwijzen hoe goed deze DNA-vectoren zijn.
Wetenschappers selecteerden vectoren gebaseerd op adenovirussen, omdat vaccinatie hiermee leidde tot de meeste neutraliserende antistoffen tegen virussen zoals SARS (Figuur 9). Het adenovirus bevat een aantal genen die kanker kunnen veroorzaken, met name de E1 en E4. Deze genen worden daarom ook uit de vectoren gehaald. Adenovirus-vectoren zijn al een aantal jaren in ontwikkeling voor vaccins tegen tuberculose, malaria en meerdere virussen, zoals Ebola, Zika, influenza en HIV. In vroege klinische studies bleken deze veilig. Een klinische studie naar HIV-vaccinatie is echter destijds afgebroken vanwege gebrek aan veiligheid. De onderzoekers waarschuwen voor een mogelijk verhoogde gevoeligheid voor HIV.
Zoals eerder bediscussieerd, kunnen de hogere antistoftiters door adenovectoren zowel een voordeel als een nadeel zijn voor de werking van dit vaccin vergeleken met mRNA vaccins. Klinisch onderzoek zal moeten uitwijzen hoe goed deze DNA-vectoren zijn.
Varianten van vectoren.
De meeste DNA-vectoren zijn afgeleid van virussen, maar dan niet-replicerend in de mens. Voor replicatie is een hulpvector nodig die niet in het vaccin zit dat wordt ingespoten. Dat geldt ook voor alle vier de vaccins die in fase 3 studies zitten. Zij kunnen zich anders dan verzwakte virussen, dus niet vermenigvuldigen in de mens. De aanwezigheid van verschillende virusgenen stuurt de afweerrespons een beetje bij.
Een andere grote groep bestaat uit de virale vectoren die zich wel kunnen repliceren. Klinisch gezien lijken die op verzwakte virussen, theoretisch gezien minder veilig maar geven vaak sterkere afweerreacties doordat ze een kleine infectie veroorzaken.
Tenslotte heeft een bedrijf een bacteriële vector ontwikkeld die zich vermenigvuldigt in bacteriën.
De meeste DNA-vectoren zijn afgeleid van virussen, maar dan niet-replicerend in de mens. Voor replicatie is een hulpvector nodig die niet in het vaccin zit dat wordt ingespoten. Dat geldt ook voor alle vier de vaccins die in fase 3 studies zitten. Zij kunnen zich anders dan verzwakte virussen, dus niet vermenigvuldigen in de mens. De aanwezigheid van verschillende virusgenen stuurt de afweerrespons een beetje bij.
Een andere grote groep bestaat uit de virale vectoren die zich wel kunnen repliceren. Klinisch gezien lijken die op verzwakte virussen, theoretisch gezien minder veilig maar geven vaak sterkere afweerreacties doordat ze een kleine infectie veroorzaken.
Tenslotte heeft een bedrijf een bacteriële vector ontwikkeld die zich vermenigvuldigt in bacteriën.
Vectoren in fase 3
Alle vectoren in fase 3 studies zijn adenovectoren. Het Russische Sputnik V vaccin dat in augustus in Rusland werd geregistreerd valt in deze categorie. De klinische fase 1 en 2 van dit vaccin zijn gepubliceerd, maar de fase 3 studie, die effectiviteit en veiligheid onderzoekt bij mensen die besmet worden met SARS-2, loopt nog. Europese en Amerikaanse wetenschappers twijfelen daarom aan de veiligheid en effectiviteit van dit vaccin omdat de testprocedure niet transparant volgens de regels is gegaan.
Een tweede adenovirus vaccin is CanSino uit China. Ook dit wordt niet in Nederland gebruikt.
Oxford en AstraZeneca (ChAdOx1-S) hebben samen de fase 3 studie al afgerond en dit vaccin wordt sinds 1 oktober beoordeeld door de EMA voor registratie.
Het vaccin (Ad26.COV2.S) van het Leidse bedrijf Janssen Pharmaceutical Companies is in een fase 3 studie ontwikkeld.
Nederland heeft beide adenovector vaccins (Oxford en Janssen) op de lijst staan om aan te kopen mits de EMA-registratie goedkeurt.
Alle vectoren in fase 3 studies zijn adenovectoren. Het Russische Sputnik V vaccin dat in augustus in Rusland werd geregistreerd valt in deze categorie. De klinische fase 1 en 2 van dit vaccin zijn gepubliceerd, maar de fase 3 studie, die effectiviteit en veiligheid onderzoekt bij mensen die besmet worden met SARS-2, loopt nog. Europese en Amerikaanse wetenschappers twijfelen daarom aan de veiligheid en effectiviteit van dit vaccin omdat de testprocedure niet transparant volgens de regels is gegaan.
Een tweede adenovirus vaccin is CanSino uit China. Ook dit wordt niet in Nederland gebruikt.
Oxford en AstraZeneca (ChAdOx1-S) hebben samen de fase 3 studie al afgerond en dit vaccin wordt sinds 1 oktober beoordeeld door de EMA voor registratie.
Het vaccin (Ad26.COV2.S) van het Leidse bedrijf Janssen Pharmaceutical Companies is in een fase 3 studie ontwikkeld.
Nederland heeft beide adenovector vaccins (Oxford en Janssen) op de lijst staan om aan te kopen mits de EMA-registratie goedkeurt.
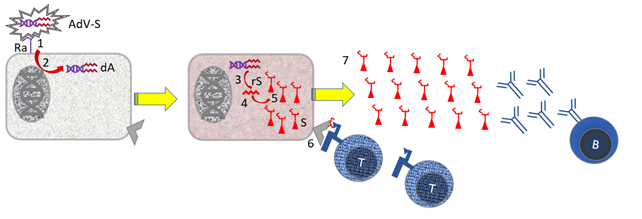
Figuur 11. Werking van een adenovector vaccin met SARS-2 Spike
Onderdelen: [B] B-cel; [AdV-S} Adenovirus vector met toegevoegd Spike gen; [dA} DNA van adenovirus vector inclusief Spike gen [Ra] Receptor voor adenovirus vector [rS] RNA coderend voor Spike eiwit; [rV] Virus RNA coderend voor cellulaire genen; [S] Virus Spike eiwit dat bindt aan de ACE-2 Receptor voor infectie. [Tc] cytotoxische T cel; [V] virus.
Stapsgewijs mechanisme: [1] De adenovirus vector bindt aan cellen met de receptor voor deze vector [2] Receptor-binding induceert membraanfusie en het vector DNA komt in het cytoplasma van de cel. [3] Het vector DNA wordt vermenigvuldigd [4] Het vector DNA wordt aflezen naar mRNA [5] Door het vertalen van het virus mRNA worden in de cel virus eiwitten gemaakt. [6] Kleine stukjes viruseiwitten (peptiden) worden in de context van MHC I gepresenteerd aan cytotoxische T-cellen [Tc]. [7] vrij virus wordt geproduceerd, waartegen B-cellen antistoffen maken.
Niet getekend: Stappen 6 + 7 worden ondersteund doordat specialistische afweercellen (dendritische cellen; DC) Kleine stukjes viruseiwitten in de context van MHC-II presenteren aan helper T-cellen [Th]. Zie afbeelding 5 in Veiligheid voor de huid zonder dierenleed.
Onderdelen: [B] B-cel; [AdV-S} Adenovirus vector met toegevoegd Spike gen; [dA} DNA van adenovirus vector inclusief Spike gen [Ra] Receptor voor adenovirus vector [rS] RNA coderend voor Spike eiwit; [rV] Virus RNA coderend voor cellulaire genen; [S] Virus Spike eiwit dat bindt aan de ACE-2 Receptor voor infectie. [Tc] cytotoxische T cel; [V] virus.
Stapsgewijs mechanisme: [1] De adenovirus vector bindt aan cellen met de receptor voor deze vector [2] Receptor-binding induceert membraanfusie en het vector DNA komt in het cytoplasma van de cel. [3] Het vector DNA wordt vermenigvuldigd [4] Het vector DNA wordt aflezen naar mRNA [5] Door het vertalen van het virus mRNA worden in de cel virus eiwitten gemaakt. [6] Kleine stukjes viruseiwitten (peptiden) worden in de context van MHC I gepresenteerd aan cytotoxische T-cellen [Tc]. [7] vrij virus wordt geproduceerd, waartegen B-cellen antistoffen maken.
Niet getekend: Stappen 6 + 7 worden ondersteund doordat specialistische afweercellen (dendritische cellen; DC) Kleine stukjes viruseiwitten in de context van MHC-II presenteren aan helper T-cellen [Th]. Zie afbeelding 5 in Veiligheid voor de huid zonder dierenleed.
DNA-vaccins
Waar vectoren nog (virale) eiwitten hebben, zijn DNA-vaccins vrij van dergelijke structuren. Voor het toedienen van DNA-vaccins zijn speciale middelen nodig zoals electroporatie. Bij electroporatie wordt een stroompje gebruikt om DNA in cellen te schieten. Deze vaccins zitten echter nog allemaal in vroege studies.
RNA-vaccins
Messenger RNA (mRNA) vaccins zijn een zeer recente vinding gebaseerd op chemische technologie om synthetisch RNA en lipide membranen te maken. Dit is een doorbraak in vaccintechnologie waardoor vaccins nog sneller gemaakt en opgeschaald kunnen worden, zonder de noodzaak van complexe opschaling van celkweekreactoren. Het werkingsmechanisme (Figuur 11) is veelbelovend.
De persberichten over de fase 3 trials zijn voor de mRNA vaccins van Moderna (mRNA-1273) en Pfizer/BioNTech (BNT162b2) spreken over onverwacht goede resultaten. Beide vaccins zitten ook sinds 6 oktober en 16 november in het proces van registratie door de EMA. Nederland heeft een contract met Pfizer en praat met Moderna en CureVac (CVnCoV) voor aankopen van het vaccin. Voor CureVac loopt nu een klinische fase 2 studie, waarin men de juiste dosis probeert te vinden.
De persberichten over de fase 3 trials zijn voor de mRNA vaccins van Moderna (mRNA-1273) en Pfizer/BioNTech (BNT162b2) spreken over onverwacht goede resultaten. Beide vaccins zitten ook sinds 6 oktober en 16 november in het proces van registratie door de EMA. Nederland heeft een contract met Pfizer en praat met Moderna en CureVac (CVnCoV) voor aankopen van het vaccin. Voor CureVac loopt nu een klinische fase 2 studie, waarin men de juiste dosis probeert te vinden.
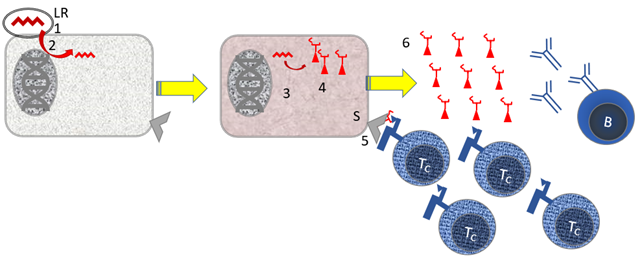
Figuur 12. Werking van mRNA vaccins.
Onderdelen: [B] B-cel; [LR} Lipide met (messenger) RNA [Tc] cytotoxische T cel.
Stapsgewijs mechanisme: [1] De lipiden met mRNA binden, mogelijk aspecifiek, aan cellen [2] Het mRNA wordt opgenomen in het cytoplasma van de cel. Opvallend is dat het erfelijk materiaal niet vermenigvuldigd wordt in het cytoplasma, waardoor een versterkingsmechanisme niet gebruikt wordt. [3] het mRNA voor het Spike eiwit wordt afgelezen inde cel naar virus eiwit. [4] Kleine stukjes viruseiwitten (peptiden) worden in de context van MHC I gepresenteerd aan cytotoxische T-cellen [Tc]. [5] vrij virus wordt geproduceerd, waartegen B-cellen antistoffen maken.
Niet getekend: Stappen 4 + 5 worden ondersteund doordat specialistische afweercellen (dendritische cellen; DC) Kleine stukjes viruseiwitten in de context van MHC-II presenteren aan helper T-cellen [Th].
Onderdelen: [B] B-cel; [LR} Lipide met (messenger) RNA [Tc] cytotoxische T cel.
Stapsgewijs mechanisme: [1] De lipiden met mRNA binden, mogelijk aspecifiek, aan cellen [2] Het mRNA wordt opgenomen in het cytoplasma van de cel. Opvallend is dat het erfelijk materiaal niet vermenigvuldigd wordt in het cytoplasma, waardoor een versterkingsmechanisme niet gebruikt wordt. [3] het mRNA voor het Spike eiwit wordt afgelezen inde cel naar virus eiwit. [4] Kleine stukjes viruseiwitten (peptiden) worden in de context van MHC I gepresenteerd aan cytotoxische T-cellen [Tc]. [5] vrij virus wordt geproduceerd, waartegen B-cellen antistoffen maken.
Niet getekend: Stappen 4 + 5 worden ondersteund doordat specialistische afweercellen (dendritische cellen; DC) Kleine stukjes viruseiwitten in de context van MHC-II presenteren aan helper T-cellen [Th].
John Jacobs
28 november 2020
28 november 2020