COVID-19
Onnavolgbaar beleid dat verkeerd uitpakt
4. Zijn de vaccins goed?
John Jacobs, 20 december 2020. |
Medische wetenschap vraagt om bewijs voor behandeling uit onderzoek, maar niet al het onderzoek levert bewijs. Daarom ga ik eerst kort in op exploratief versus bewijzend onderzoek en gebruik ik dat daarna om het vaccinonderzoek uit te leggen.
Medische wetenschap kent twee fasen± exploratief onderzoek en bewijzend onderzoek.
Medische wetenschap kent twee fasen± exploratief onderzoek en bewijzend onderzoek.
Ontdekkingstocht
In exploratief onderzoek gaan wetenschappers flexibel op ontdekking om nieuwe hypotheses te ontdekken. Inzicht in mechanismen, consistentie en creativiteit zijn daarbij handige gidsen, maar niet strikt noodzakelijk. Elke idioot kan op grond van data hypotheses verzinnen die statistisch significant zijn. Bij willekeurige hypothesen geldt dat 1 op de 20 een kans heeft van p<0.05, de meest gebruikte norm voor statistisch significant in wetenschappelijk onderzoek. Als de norm verlaagd wordt na p<0.001 moeten gemiddeld duizend hypotheses worden verzonnen, voor 1 statistisch significant effect. In theorie zijn eindeloos veel nieuwe ideeën te verzinnen, op grond van data dit al bekend is (zie box 1). In honderdduizend hypothesen gebeurt dit ook gemiddeld 100x toevallig. Dus de p-waarde voor kans zegt weinig als niet bekend is hoeveel hypothesen getoetst zijn.
In een goede ontdekkingstocht wordt gekeken naar hoe de data overeenkomt met wat al bekend is, zodat de meest waarschijnlijke hypotheses overblijven. In dit deel wordt het eerste onderscheid gemaakt tussen random statistische correlatie, complottheorieën van nul en generlei waarde, radicale nieuwe inzichten en subtiele variatie die kan leiden tot voortschrijdend inzicht. Hoe radicaler een nieuw inzicht is, hoe meer wetenschappelijk bewijs nodig is. Aantonen dat een aangrenzende leeftijdsgroep ook beschermd is door een vaccin vraagt minder aanvullend bewijs dan aantonen dat een vaccin tegen een ziekte ook beschermt tegen andere zaken.
Exploratief onderzoek kunnen computermodellen zijn, theoretische constructies, data verkenningen, laboratoriumstudies, dierproeven en klinische fase 2 studies. Exploratief onderzoek is per definitie nooit bewijzend, omdat niet vastligt hoeveel hypotheses er zijn.
In een goede ontdekkingstocht wordt gekeken naar hoe de data overeenkomt met wat al bekend is, zodat de meest waarschijnlijke hypotheses overblijven. In dit deel wordt het eerste onderscheid gemaakt tussen random statistische correlatie, complottheorieën van nul en generlei waarde, radicale nieuwe inzichten en subtiele variatie die kan leiden tot voortschrijdend inzicht. Hoe radicaler een nieuw inzicht is, hoe meer wetenschappelijk bewijs nodig is. Aantonen dat een aangrenzende leeftijdsgroep ook beschermd is door een vaccin vraagt minder aanvullend bewijs dan aantonen dat een vaccin tegen een ziekte ook beschermt tegen andere zaken.
Exploratief onderzoek kunnen computermodellen zijn, theoretische constructies, data verkenningen, laboratoriumstudies, dierproeven en klinische fase 2 studies. Exploratief onderzoek is per definitie nooit bewijzend, omdat niet vastligt hoeveel hypotheses er zijn.
|
Box 1.Talrijke hypotheses.
In een bestand van 1.000 random dobbelresultaten zijn vele hypotheses (h) te verzinnen. De eerste groep is de hypothese dat de 2e worp verschilt van de 1e in 2-tallen (t), of de 1e van de 2e, de 2e van de 3e of de 3e van de 1e. Dat loopt geleidelijk op van 1 naar 3, 6, 10, 15, 21 enzovoorts – formule aantal hypotheses = ½ t * (t-1)). Als deze tweetallen tot 100 wordt doorgetrokken zijn er al 166.650 verschillende hypothesen mogelijk in opvolgende tweetallen. Dan zijn er nog andere mogelijkheden van indelen zoals de eerste helft t.o.v de tweede helft (i.p.v. om en om) met eenzelfde aantal mogelijke combinaties. Een creatief brein komt makkelijk aan miljoenen opties, zeker als er meer parameters zijn met ook nog mogelijke interacties tussen parameters. |
Bewijzend onderzoek
Bewijs wordt verkregen door klinische fase 3 studies (randomized controlled trial; RCT), waarin wordt gekeken naar een hoofdhypothese en een beperkt en gedefinieerd aantal bijvragen. De statistische power is het grootst voor het hoofdeffect – daar hoeft niet gecorrigeerd te worden voor het aantal vragen. Voor de bijvragen wordt wel gecorrigeerd voor het aantal, dus een goede opzet is cruciaal. Vaak geeft de data uit een bewijzende fase 3 studie aanleiding tot nieuwe vragen. Dit is dan exploratief dataonderzoek dat kan leiden tot nieuwe hypotheses. Die nieuwe hypotheses moeten weer worden getoetst in bewijzend onderzoek. Het onderscheid tussen beide is belangrijk, maar wordt niet altijd goed gemaakt.
Gebrek aan onderscheid tussen exploratief en bewijzend onderzoek is een belangrijke reden dat de meeste gepubliceerde wetenschappelijke data niet waar is.
Gebrek aan onderscheid tussen exploratief en bewijzend onderzoek is een belangrijke reden dat de meeste gepubliceerde wetenschappelijke data niet waar is.
Vaccin onderzoek
Exploratief onderzoek gebeurt voor 166 vaccins in preklinische studies, met 56 in klinische studies, waarvan 14 in fase 3 RCT-studies. Voor drie vaccins is de eerste evaluatie van de RCTs uitgevoerd. Het protocol was een eerste vaccinatie gevolgd door een tweede na 28 dagen, Vanaf 14 dagen na de tweede vaccinatie start de studie opvolging om de bescherming te meten door vaccinatie. Bij de Pfizerstudie is dit al na 7 dagen. Immunologen weten dat vaccins tijd nodig hebben om een specifieke afweerreactie op te bouwen die zorgt voor blijvende immuniteit. Een te snelle opvolging kan, zeker bij korte studies, zorgen dat immuniteit overschaduwd wordt door tijdelijke immunologische effecten van vaccinatie, zoals interferon.
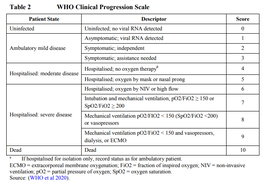
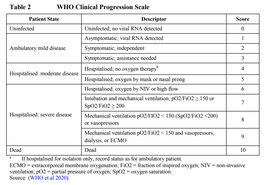
In de Oxford trial worden scores van 4 (ziekte met opname in het ziekenhuis) en score 6 (ernstige ziekte) als grenswaarde aangehouden, zoals de WHO adviseert (Figuur 1). De RNA-vaccins hebben een andere definitie van COVID-19, te weten symptomatische ziekte met positieve RT-PCR en ten minste twee systemische symptomen (zoals koorts) of 1 respiratoir symptoom. Dit lijkt op score 2.
Opvallend in alle studies is dat het percentage besmettingen in de ouderen veel lager is dan in de jongvolwassenen. Waarschijnlijk zijn oudere mensen voorzichtiger dan jongeren die minder risico lopen na infectie.
In de Oxford trial worden scores van 4 (ziekte met opname in het ziekenhuis) en score 6 (ernstige ziekte) als grenswaarde aangehouden, zoals de WHO adviseert (Figuur 1). De RNA-vaccins hebben een andere definitie van COVID-19, te weten symptomatische ziekte met positieve RT-PCR en ten minste twee systemische symptomen (zoals koorts) of 1 respiratoir symptoom. Dit lijkt op score 2.
Opvallend in alle studies is dat het percentage besmettingen in de ouderen veel lager is dan in de jongvolwassenen. Waarschijnlijk zijn oudere mensen voorzichtiger dan jongeren die minder risico lopen na infectie.
Figuur 1. Definities van ernst van COVID-19 volgens de WHO.
Oxford vaccin voor volwassenen tot 55 jaar
De resultaten van de Oxford vaccin studies zijn verwarrend, omdat niet voor alle resultaten het protocol is gevolgd. Het is dus een mengelmoes van een exploratieve en een bewijzende studie.
De beste bescherming (90%) was geassocieerd met de afwijking van het protocol, waarin een lagere dosis werd gegeven met een langere tussentijd. Zoals eerder betoogd vragen wetenschappelijke principes om een dergelijke studie als exploratief te zien en niet als bewijzend. De betere resultaten in het afwijkende protocol kunnen interessant zijn om een nieuwe bewijzende studie op te zetten. In de verdere bespreking ga ik alleen in op de behandeling volgens protocol.
De bescherming van de bewijzende studie staat op 62% (41 tot 76%) met een opvolging van maximaal 2 maanden. Het 95% betrouwbaarheidsinterval laat de betrouwbaarheidsmarge van het resultaat zien. Het kan dus zijn dat iets minder dan de helft van de mensen door dit vaccin wordt beschermd. Het aantal mensen met COVID-19 was 27/4440 (0,6%) in de vaccingroep versus 71/4455 (1,6%) in de behandelgroep.
Het Oxford vaccin bood ongeveer 60% bescherming tegen ziekte in mensen onder de 55 jaar. De studie laat niet direct de resultaten zien bij mensen van 56+, maar een berekening laat zien dat dit gaat om 1/498 en 3/508 ziektes in vaccin- en controlegroep. Dergelijke aantallen zijn te laag om iets te kunnen zeggen over bescherming., hetgeen betekent dat de studie langer moet lopen. Daarbij is ook belangrijk dat slechts ⅕ van de deelnemers 56+ is. De conclusie is dat deze studie langer moet lopen, zodat meer mensen besmet worden en duidelijker wordt hoeveel het vaccin beschermt in mensen boven de 55 jaar.
De studie keek ook naar bescherming tegen asymptomatische infecties. De studie detecteerde 22/2168 en 23/2223 asymptomatische infecties in de vaccin en controlegroep, respectievelijk. Dit is gemiddeld 4% bescherming met volgens de auteurs een betrouwbaarheidsinterval van −72% tot +46%. De negatieve waarde betekent dat vaccinatie het risico op infectie zou vergroten. Waarschijnlijk is de conclusie dat het vaccin niet beschermt tegen infectie.
De beste bescherming (90%) was geassocieerd met de afwijking van het protocol, waarin een lagere dosis werd gegeven met een langere tussentijd. Zoals eerder betoogd vragen wetenschappelijke principes om een dergelijke studie als exploratief te zien en niet als bewijzend. De betere resultaten in het afwijkende protocol kunnen interessant zijn om een nieuwe bewijzende studie op te zetten. In de verdere bespreking ga ik alleen in op de behandeling volgens protocol.
De bescherming van de bewijzende studie staat op 62% (41 tot 76%) met een opvolging van maximaal 2 maanden. Het 95% betrouwbaarheidsinterval laat de betrouwbaarheidsmarge van het resultaat zien. Het kan dus zijn dat iets minder dan de helft van de mensen door dit vaccin wordt beschermd. Het aantal mensen met COVID-19 was 27/4440 (0,6%) in de vaccingroep versus 71/4455 (1,6%) in de behandelgroep.
Het Oxford vaccin bood ongeveer 60% bescherming tegen ziekte in mensen onder de 55 jaar. De studie laat niet direct de resultaten zien bij mensen van 56+, maar een berekening laat zien dat dit gaat om 1/498 en 3/508 ziektes in vaccin- en controlegroep. Dergelijke aantallen zijn te laag om iets te kunnen zeggen over bescherming., hetgeen betekent dat de studie langer moet lopen. Daarbij is ook belangrijk dat slechts ⅕ van de deelnemers 56+ is. De conclusie is dat deze studie langer moet lopen, zodat meer mensen besmet worden en duidelijker wordt hoeveel het vaccin beschermt in mensen boven de 55 jaar.
De studie keek ook naar bescherming tegen asymptomatische infecties. De studie detecteerde 22/2168 en 23/2223 asymptomatische infecties in de vaccin en controlegroep, respectievelijk. Dit is gemiddeld 4% bescherming met volgens de auteurs een betrouwbaarheidsinterval van −72% tot +46%. De negatieve waarde betekent dat vaccinatie het risico op infectie zou vergroten. Waarschijnlijk is de conclusie dat het vaccin niet beschermt tegen infectie.
RNA-vaccins beschermen alle leeftijden
Moderna
De Moderna studie had bij alle de volwassen tot 65 jaar 7/10551 versus 156/10521 infecties in de vaccin- en behandelgroep, respectievelijk, met een efficiëntie van 94.1% (89.3% tot 96.8%). Bij de 65-plussers waren de getallen 4/3583 versus 29/3552 met een bescherming van 86.4%;(61.4% tot 95.5%). Ernstige COVID-19 werd alleen gezien in de placebogroep (30 gevallen). Hiervan is geen betrouwbaarheidsinterval berekend.
Pfizer
Pfizer begint al na 7 dagen met de analyse, een week eerder dan de andere studies. De publicatie laat 8/19.198 versus 162/18.325 infecties zien in de vaccin- en behandelgroep, respectievelijk, met een efficiëntie van 95% (90% tot 98%). In de studie was 42%, 22% en 4%, boven de 55 jaar, 65 jaar en 75 jaar, respectievelijk. De effecten zijn vergelijkbaar tussen de deelnemers van 16 tot 55 jaar, ouder dan 55, 65 of 75 jaar, maar de laatste groep is niet significant, omdat deze te klein is. In de groep ouder dan 65 jaar zijn 1/3.848 versus 19/3.880 mensen geïnfecteerd geworden dus een efficiëntie van 95% (67 tot 99.9%).
De auteurs kennen de beperkingen van hun studie: “These data do not address whether vaccination prevents asymptomatic infection”.
De Moderna studie had bij alle de volwassen tot 65 jaar 7/10551 versus 156/10521 infecties in de vaccin- en behandelgroep, respectievelijk, met een efficiëntie van 94.1% (89.3% tot 96.8%). Bij de 65-plussers waren de getallen 4/3583 versus 29/3552 met een bescherming van 86.4%;(61.4% tot 95.5%). Ernstige COVID-19 werd alleen gezien in de placebogroep (30 gevallen). Hiervan is geen betrouwbaarheidsinterval berekend.
Pfizer
Pfizer begint al na 7 dagen met de analyse, een week eerder dan de andere studies. De publicatie laat 8/19.198 versus 162/18.325 infecties zien in de vaccin- en behandelgroep, respectievelijk, met een efficiëntie van 95% (90% tot 98%). In de studie was 42%, 22% en 4%, boven de 55 jaar, 65 jaar en 75 jaar, respectievelijk. De effecten zijn vergelijkbaar tussen de deelnemers van 16 tot 55 jaar, ouder dan 55, 65 of 75 jaar, maar de laatste groep is niet significant, omdat deze te klein is. In de groep ouder dan 65 jaar zijn 1/3.848 versus 19/3.880 mensen geïnfecteerd geworden dus een efficiëntie van 95% (67 tot 99.9%).
De auteurs kennen de beperkingen van hun studie: “These data do not address whether vaccination prevents asymptomatic infection”.
Alleen verder gezonde mensen zijn getest
Op uitdrukkelijk verzoek van de EMA en de FDA zijn mensen geïncludeerd uit risicogroepen (oude mensen, mensen met hart- en vaatziekte, hoog BMI). Echter mensen met SARS-2 infectie en/of antistoffen worden niet meegenomen in de studie. Ook mensen met een acute andere ziekte worden niet in de vaccinstudies getest. Er is beperkt gekeken na comorbiditeit. Vaccinatie met de RNA-vaccins leidt vaak tot verkoudheidsklachten. Volgens de meest uitgebreide gegevens (Pfizer), krijgt ongeveer 3 tot 4‰ koorts na vaccinatie. Dat is ongeveer 2x zo hoog dan in de controlegroep. Ongeveer een tiende deel daarvan krijgt ruim 39˚C.
Vaccinatie is niet absoluut
Mensen in landen die coronavrij zijn, zoals in Oost-Azië en Australië, zijn absoluut beschermd tegen infectie. Mensen die gevaccineerd zijn, hebben ook bescherming maar geen 100%. Bij 90% effectiviteit daalt het aantal zieken met een factor 10, bij 95% een factor 20. Tussen november 2020 en 18 december stierven 336 tot 616 mensen per week. Dan zou 90% winst door vaccinatie 34 tot 62 overlijdens per week betekenen, vergeleken met 0 tot 15 voor de periode vanaf 2 juli. Voorkomen van besmetting is dus belangrijker dan bescherming tegen ziekte.
Hoe lang beschermen vaccins?
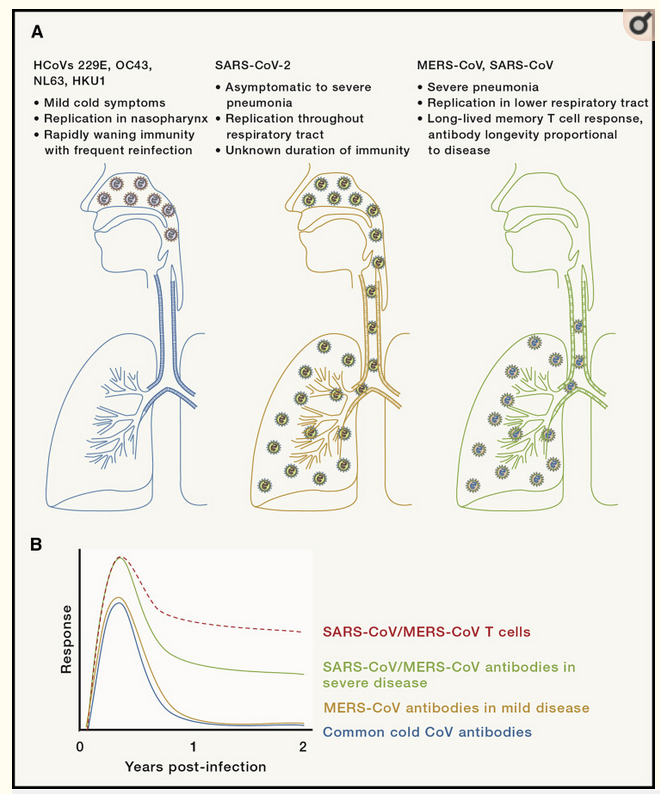
Veel vaccins werken langdurig of zelfs levenslang, net zoals de immuniteit na infectie die vaak levenslang is. Echter voor coronavirussen is de natuurlijke immuniteit kort en ook vaccins beschermen niet altijd lang. Vaccinatie van kippen tegen het coronavirus IBV beschermde deze gedurende 9 weken. Immuniteit tegen de coronavirussen die verkoudheid veroorzaken is duurt ongeveer 6 maanden. Op grond van immunologische reacties, vermoeden sommige wetenschappers dat de immuniteit tegen SARS-1 en MERS langer blijft (Figuur 2). Uit het kankeronderzoek weet ik dat aanwezigheid van immuun herkenning niet betekent dat cellen ook effectief zijn. Antistoffen en cellulaire immuniteit geven een idee, maar geen zekerheid. Immuniteit wordt bepaald in blootstelling aan het virus en dat is niet gedaan voor SARS-1 en MERS, maar wel voor de 4 andere coronavirussen.
De vaccinstudies hebben echter alleen gekeken of het vaccin in de eerste twee of drie maanden beschermt. Op de uitkomsten van langere bescherming moeten we vooral langer wachten. Westerse landen zien bewijs voor twee of drie maanden bescherming voldoende om alvast te beginnen met vaccinatie. De vraag is of dit meer verteld over het onvermogen om de epidemie te controleren zoals Oost-Azië doet, of over het wetenschappelijk onderbouwde vertrouwen in immuniteit.
De vaccinstudies hebben echter alleen gekeken of het vaccin in de eerste twee of drie maanden beschermt. Op de uitkomsten van langere bescherming moeten we vooral langer wachten. Westerse landen zien bewijs voor twee of drie maanden bescherming voldoende om alvast te beginnen met vaccinatie. De vraag is of dit meer verteld over het onvermogen om de epidemie te controleren zoals Oost-Azië doet, of over het wetenschappelijk onderbouwde vertrouwen in immuniteit.
Figuur 2. Immuun parameters na verschillende coronavirussen.
Verkoudheidsvirussen (links) infecteren de lagere luchtwegen en de antistoffen verdwijnen binnen 1 jaar. Daarna zijn mensen weer kwetsbaar voor een nieuwe infectie en ziekte. SARS-1 en MERS infecteren in de longen en de antistoffen titers nemen af binnen 2 jaar. Ook is er T-cel activiteit aanwezig. Het is echter niet bekend of deze immuniteit daadwerkelijk beschermt. SARS-2 infecteert zowel de hogere luchtwegen (verkoudheidsklachten) als de longen (stevige griep) en kan ook leiden tot systemische infectie (niet aangegeven), waarbij het virus zich door het gehele lichaam verspreid. Over de duur van immuniteit is na SARS-2 is nog weinig bekend en veel discussie.
Verkoudheidsvirussen (links) infecteren de lagere luchtwegen en de antistoffen verdwijnen binnen 1 jaar. Daarna zijn mensen weer kwetsbaar voor een nieuwe infectie en ziekte. SARS-1 en MERS infecteren in de longen en de antistoffen titers nemen af binnen 2 jaar. Ook is er T-cel activiteit aanwezig. Het is echter niet bekend of deze immuniteit daadwerkelijk beschermt. SARS-2 infecteert zowel de hogere luchtwegen (verkoudheidsklachten) als de longen (stevige griep) en kan ook leiden tot systemische infectie (niet aangegeven), waarbij het virus zich door het gehele lichaam verspreid. Over de duur van immuniteit is na SARS-2 is nog weinig bekend en veel discussie.
Wat weten we niet van de vaccins?
We weten niet of de vaccins beschermen tegen long covid. Ongeveer 10% van de mensen heeft na drie maanden nog serieuze klachten van COVID-19. Long covid is een vervelende en slecht begrepen nasleep van COVID-19 die niet gecorreleerd lijkt te zijn aan de ernst van de ziekte en risicofactoren. Ik hoop en denk dat we hier een meevaller hebben.
De drie gepubliceerde vaccins zijn effectief in het voorkomen van ziekte, maar niet in het voorkomen van infectie. Ze zijn niet geschikt voor de opbouw van groepsimmuniteit. Sterker. omdat vaccinatie leidt tot virusinfectie zonder klachten worden geïnfecteerde mensen nog minder vaak alert op het feit dat ze anderen kunnen besmetten. Je laten vaccineren voor anderen heeft geen zin, vaccineren doe je voor je eigen bescherming. Mensen die niet gevaccineerd zijn, zijn niet beschermd door andere die wel gevaccineerd zijn (geen groepsimmuniteit). Eisen dat iemand gevaccineerd om andere te beschermen is onzinnig.
De drie gepubliceerde vaccins zijn effectief in het voorkomen van ziekte, maar niet in het voorkomen van infectie. Ze zijn niet geschikt voor de opbouw van groepsimmuniteit. Sterker. omdat vaccinatie leidt tot virusinfectie zonder klachten worden geïnfecteerde mensen nog minder vaak alert op het feit dat ze anderen kunnen besmetten. Je laten vaccineren voor anderen heeft geen zin, vaccineren doe je voor je eigen bescherming. Mensen die niet gevaccineerd zijn, zijn niet beschermd door andere die wel gevaccineerd zijn (geen groepsimmuniteit). Eisen dat iemand gevaccineerd om andere te beschermen is onzinnig.
John Jacobs
20 december 2020
20 december 2020