John Jacobs, 26 februari 2003
Het afweersysteem kan hele organen afstoten, dus waarom geen kankergezwel (tumor)? Dierproeven hebben laten zien dat grote, uitgezaaide tumoren van wel 1 – 2% van het lichaamsgewicht kunnen worden afgestoten. Sommige patiënten met bepaalde vormen van kanker kunnen inderdaad door stimulatie van het afweersysteem worden genezen. Bij andere patiënten geeft dit echter geen verbetering. De vragen hoe en wanneer het afweersysteem te stimuleren, en bij welke tumoren, zijn cruciaal bij het ontwikkelen van een nieuwe effectieve therapie tegen nu nog ongeneeslijke vormen van uitgezaaide kanker.
Ongeneeslijk zieke kankerpatiënten genezen soms ‘spontaan’. Niet zelden begint de genezing na een zware infectie. Aangezien een infectie het afweersysteem stimuleert, werd de suggestie geopperd dat het afweersysteem op eigen kracht een kankergezwel kan opruimen. In de eerste experimenten met proefdieren werden bacteriën gebruikt om het afweersysteem te activeren. Soms bleek deze aanpak succesvol bij de bestrijding van ‘ongeneeslijke’ tumoren. Sindsdien wordt, met wisselend succes, het afweersysteem gestimuleerd om tumoren te laten verdwijnen.
Huidige anti-kanker therapie
Een goedaardig kankergezwel groeit niet hard en blijft beperkt tot het weefsel waarin het groeit. Goedaardige gezwellen worden meestal operatief verwijderd. Kwaadaardige tumoren kunnen echter ook nog uitzaaiingen (metastasen) veroorzaken. Dit zijn losgeraakte ‘op hol geslagen’ cellen die zich op een andere plek in het lichaam kunnen nestelen en daar gaan woekeren. In dat geval, kan vaak alleen de oorspronkelijke tumor worden verwijderd, maar niet de uitzaaiingen. Echter, de uitzaaiingen zijn meestal de belangrijkste oorzaak van de dood van de patiënt. Het behandelen van uitzaaiingen is moeilijk, omdat ze vaak op vele plaatsen in het lichaam verdeeld zitten. Hierdoor is het onmogelijk ze via een operatie te verwijderen.
Een ideale therapie valt alleen kankercellen aan en laat de gezonde lichaamscellen met rust. Bestaande therapieën als chemotherapie en bestraling doden inderdaad de snel delende tumorcellen. Maar helaas delen ook vele lichaamscellen zich snel, waaronder die van de darmen, huid, haren en de bloedvormende cellen uit het beenmerg. Het aspecifieke doden van normale cellen door deze therapieën zorgt voor bijwerkingen zoals haaruitval, schraalheid van de huid en onderdrukking van het afweersysteem. Omdat deze bijwerkingen dodelijk kunnen zijn voor de patiënt kan de huidige anti-kanker therapie niet met volle kracht worden ingezet.
De kracht van het afweersysteem.
Bij sterfte van de patiënt is de tumor in gewicht vaak 1 – 2 % van het lichaamsgewicht. Orgaantransplantaties hebben laten zien dat het afweersysteem hele organen (nier, hart, etc.) kan afstoten. De snelheid van afstoting is verschillend, soms in een tijdsbestek van uren, maar als de reactie minder fel is kan het ook dagen, weken, maanden of jaren duren.
De tumoren in de kliniek die onbehandelbaar zijn voor standaard anti-kanker therapie zijn ongeveer even groot als bovengenoemde getransplanteerde organen die door het afweersysteem kunnen worden vernietigd. De kracht van het afweersysteem zou dus in theorie voldoende moeten zijn om een gezwel op te ruimen. Aangezien het afweersysteem door het hele lichaam werkt kunnen op deze manier ook de uitzaaiingen door het hele lichaam worden opgeruimd. Maar dat het niet zo eenvoudig werkt komt verderop aan bod.
Kan een tumor worden aangevallen door het afweersysteem?
Tumoren, en met name de kwaadaardige, verschillen in nogal wat eigenschappen van normaal weefsel. De meeste tumoren maken eiwitten die je niet in normale cellen verwacht, niet zelden zijn het eiwitten die alleen in embryonale cellen voorkomen. Ook kunnen eiwitten veranderd zijn door mutaties in de genen. Andere eiwitten functioneren als tumor antigenen, deze speciale eiwitten worden dus door het afweersysteem herkend als ‘tumor-eiwitten’.
Het woord antigeen is een samenstelling van antistof-genererend. Een antigeen is dus een stofje waarop het afweersysteem kan reageren door het maken van een antistof gericht tegen het antigeen. Aanvallen gericht op bepaalde (veranderde) eiwitten gebeuren door het specifieke deel van het afweersysteem. Een ander deel van de afweer tegen tumoren is de natuurlijke afweer. Sommige eiwitten die belangrijk zijn voor de normale functie en bescherming van de cel zijn soms niet aanwezig in tumorcellen. Hierdoor zijn kankercellen vaak kwetsbaarder voor aanvallen van het afweersysteem. Nog een verschil tussen normaal weefsel en tumorweefsel zit hem in de bloedvaten. Omdat een tumor snel groeit zijn de bloedvaten in het gezwel vaak jong, en niet zelden ook nog anders dan normale bloedvaten in het weefsel.
Tenslotte is ook het weefsel rond de cellen (de extracellulaire matrix) in tumoren anders dan in gewoon weefsel. Al deze verschillen tussen normaal weefsel en tumor weefsel maakt dat het afweersysteem gericht actie kan ondernemen tegen de tumor. Hierbij speelt de samenwerking tussen natuurlijke en specifieke afweer een grote rol. De natuurlijke afweer kan zorgen dat specifieke afweer ontstaat. De specifieke afweer op zijn beurt kan de natuurlijke afweer stimuleren.
Afweer van nature
Het afweersysteem kent twee hoofdprincipes: de natuurlijke afweer en de specifieke afweer. Natuurlijke afweer is altijd aanwezig, maar kan worden versterkt en worden ingezet door de specifieke afweer. Specifieke afweer ontstaat pas na blootstelling aan de vreemde ‘stof’. Een voorbeeld van specifieke afweer is de immuniteit tegen kinderziektes zoals de waterpokken. De natuurlijke afweer begint bij de barrière met de buitenwereld (1e afweerlinie), zoals de huid, slijmvliezen en lysozyme (enzym dat bacterie ten gronde richt) in zweet en traanvocht.
Kanker ontstaat echter door verlies van regulatie van celgroei in de eigen lichaamscellen. De woekering begint van binnenuit, dus de 1e afweerlinie wordt omzeild. In vrijwel alle weefsels en organen van het lichaam bevinden zich macrofagen en dendritische cellen. Beide cellen komen het weefsel binnen als monocyten vanuit het bloed en vinden hun oorsprong in het beenmerg. Beide cellen hebben uitlopers, die met name bij de dendritische cel lijken op de dendrieten van zenuwcellen. Zowel macrofagen als dendritische cellen spelen een rol binnen het afweersysteem, maar met een totaal verschillende taak. Daarom worden ze tegenwoordig als twee totaal verschillende celpopulaties worden gezien.
Dendritische cellen spelen een cruciale rol bij het ontstaan van specifieke immuniteit (daarover is verderop meer te lezen). Macrofagen ruimen onder normale omstandigheden weefselafval, zoals dode cellen op. Bij een ontsteking kunnen macrofagen geactiveerd worden door bacteriën en/of door het specifieke afweersysteem. Geactiveerde macrofagen kunnen bacteriën doden en mits voldoende sterk geactiveerd ook cellen. Ook neutrofiele granulocyten kunnen op deze manier worden geactiveerd om bacteriën en eventueel cellen te doden. De neutrofielen bevinden zich normaal in de bloedcirculatie, maar worden in geval van ontsteking razendsnel gerekruteerd.
Een derde celtype zijn de natural killer (NK) cellen. NK-cellen kunnen van nature virusgeïnfecteerde cellen en sommige kankercellen doden. De meeste gezwellen die ontstaan zijn echter ongevoelige voor niet-geactiveerde NK-cellen. Het specifieke afweersysteem kan NK-cellen activeren tot een sterkere activiteit tegen kankercellen.
Specifieke afweer en immuniteit
Drie verschillende typen lymfocyten zijn verantwoordelijk voor de specifieke afweer, te weten B-cellen, Helper T cellen en celdodende (cytotoxische) T-cellen. B-cellen produceren antistoffen, celdodende T-cellen doden specifiek cellen die ze herkennen en Helper T-cellen zorgen voor de sturing van de afweer. Zoals alle cellen van het afweersysteem komen ook lymfocyten oorspronkelijk uit het beenmerg.
Maar lymfocyten hebben ook een unieke eigenschap: elke lymfocyt heeft een andere specifieke receptor waarmee die een bepaald eiwit herkent. Met z’n allen kunnen ze vrijwel alle mogelijke eiwitten herkennen. Om te voorkomen dat lymfocyten eiwitten van het eigen lichaam herkennen en daar op gaan reageren, worden die lymfocyten eruit geselecteerd. Voor B-cellen gebeurt dat in het beenmerg, voor de beide type T-cellen in een thymus, een klein afweerorgaantje, dicht bij het hart gelegen. Hierdoor heeft iedereen dus een grote groep lymfocyten die elk binden aan één lichaamsvreemd eiwit, maar allemaal tezamen reageren ze met alle mogelijke lichaamsvreemde eiwitten.
Het ontstaan van specifieke afweer
Specifieke afweer wordt opgewekt door en is gericht tegen lichaamsvreemde eiwitten die aanwezig zijn in het weefsel. Na opname van deze eiwitten, gaan de dendritische cellen via afvoerende lymfe uit het weefsel, naar de lymfeknoop. Daar presenteren de dendritische cellen op verschillende manieren de eiwitten aan de verschillende lymfocyten typen. De dendritische cellen laten de lymfocyten niet alleen de eiwitten uit het weefsel zien, maar geven ook nog extra informatie. Die extra informatie is bedoeld om de afweerreactie te sturen, en heet co-stimulatie. De belangrijkste co-stimulatie wordt opgewekt als het weefsel ‘gevaar’ loopt.
Gevaar kan iets zijn waarvan het lichaam weet dat het gevaarlijk is, zoals verschillende typen bacteriën en gisten. Op de buitenkant van bacteriën en gisten zitten bepaalde suikerverbindingen die weer op bepaalde eiwitten geplakt zitten. Het immuunsysteem kan deze vreemde suikerverbindingen onderscheiden van de lichaamseigen suikerverbindingen. Want alle eiwitten aan de buitenkant van de cellen van de mens zijn voorzien zijn van zeer specifieke suiker-structuren. Ook stress-eiwitten ( heat shock proteins) kunnen duiden op gevaar, zij komen vrij als cellen zich niet zo lekker voelen (bijvoorbeeld bij zuurstoftekort) of als de cellen dood gaan.
Behalve dat de dendritische cel met co-stimulatie vertelt dat er gevaar is, vertelt deze ook wat voor soort gevaar het is, en hoe het afweersysteem moet reageren. De co-stimulatie door de dendritische cel kan de afweerreactie sturen doordat een bepaald type helper T-cellen ontstaat, type 1 of 2. Type 1 helper T-(Th1)cellen stimuleren de aanmaak van celdodende T-cellen (zie ook afbeelding 2). Type 2 helper T-(Th2)cellen stimuleren de aanmaak van antistoffen door B-cellen. Indien co-stimulatie niet aanwezig is, dan stimuleren de dendritische cellen het ontstaan van regulerende T-cellen (Tr1).
De Tr1-cellen zorgen op hun beurt dan weer voor suppressor T-(Ts)cellen. Deze Ts en Tr1 cellen beschermen het weefsel door de afweerreactie te onderdrukken. Deze onderdrukking van het afweersysteem noemen we actieve tolerantie. De Th1, Th2 of Tr1 cellen die gevormd zijn blijven aanwezig om de afweerreactie te sturen in ‘hun’ richting, en remmen elkaars activiteit. Dus als de afweerreactie éénmaal een bepaalde ‘keuze’ heeft gemaakt wordt het moeilijker om van keuze te veranderen.
Cytokines in de afweer
Cytokines zijn kleine eiwitten die door de cellen van het afweersysteem veel worden gebruikt om met elkaar te communiceren (zie afbeelding 1). De meeste cytokines kennen vele verschillende activiteiten, mede afhankelijk van de cel die het cytokine opvangt. Bij de hierboven vermelde Th1, Th2 en Tr1 cellen horen bepaalde groepen cytokines. Aanwezigheid van die cytokines stimuleert hun eigen type afweerreactie. Is een bepaalde groep cytokines aanwezig dan stimuleert deze ook een bepaalde afweerreactie.
De cytokines remmen meestal andere typen afweerreacties. Interleukine 12 (IL-12) en interferon-lambda horen bij Th1 reacties. IL-4 en IL-5 bij Th2 reacties. IL-2 vooral bij Th1, maar ook bij Th2. IL-10 en Transforming Growth Factor- bèta (TGF-bèta) horen bij de Tr1 respons van actieve tolerantie. Dit is ook een van de oorzaken waarom TGF-bèta, zoals de naam al zegt, (transforming) kanker groei bevordert. Th2 cytokines IL-4 en IL-5 zijn bijvoorbeeld betrokken bij allergisch astma en de productie van antistoffen. IL-12 kan bloedvaten doden, en zowel IL-12 als interferon-lambda kunnen macrofagen aanzetten tot het doden van cellen. IL-2 stimuleert alle type T-cellen, NK-cellen en kan leiden tot bloedvatlekkage.
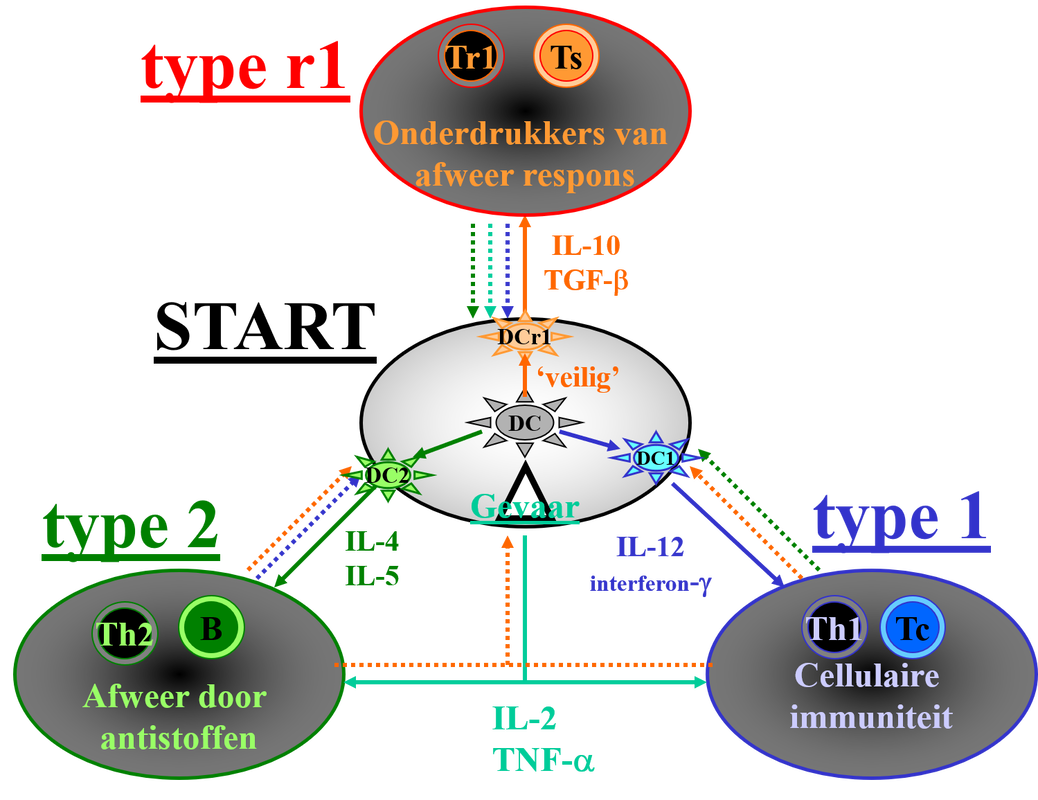
Afb. 1: Sturen van het afweersysteem door cytokines:
De dendritische cel (DC) neemt antigenen op, bijvoorbeeld van een tumor. Vervolgens kan deze op drie manieren het afweersysteem aanzetten. Hoe het afweersysteem wordt aangezet is afhankelijk van het cytokine milieu. Interleukine 12 (IL-12) en interferon-lambda zetten aan tot type 1 immuniteit. IL-4 en IL-5 zetten aan tot type 2 immuniteit. IL-2 en TNF-alfa stimuleren zowel type 1 als type 2 immuniteit. IL-10 en Transforming Growth Factor bèta (TGF- bèta) zorgen voor type r1, dat de afweerreactie onderdrukt (actieve tolerantie). Behalve dat cytokines een bepaald type afweerreactie kunnen aanzetten (aangegeven met de doorgetrokken pijlen) zullen die cytokines andere type afweerreactie remmen (aangegeven met stippellijnen in omgekeerde richting).
De dendritische cel (DC) neemt antigenen op, bijvoorbeeld van een tumor. Vervolgens kan deze op drie manieren het afweersysteem aanzetten. Hoe het afweersysteem wordt aangezet is afhankelijk van het cytokine milieu. Interleukine 12 (IL-12) en interferon-lambda zetten aan tot type 1 immuniteit. IL-4 en IL-5 zetten aan tot type 2 immuniteit. IL-2 en TNF-alfa stimuleren zowel type 1 als type 2 immuniteit. IL-10 en Transforming Growth Factor bèta (TGF- bèta) zorgen voor type r1, dat de afweerreactie onderdrukt (actieve tolerantie). Behalve dat cytokines een bepaald type afweerreactie kunnen aanzetten (aangegeven met de doorgetrokken pijlen) zullen die cytokines andere type afweerreactie remmen (aangegeven met stippellijnen in omgekeerde richting).
Immuniteit tegen kanker
In de inleiding werd verteld dat ongeneeslijk zieke kankerpatiënten soms ‘spontaan’ genezen, na het doormaken van een infectie. Het nabootsen van een infectie, door het toedienen van dode bacteriën kan soms ook patiënten doen genezen. Bij deze patiënten word gekeken of ze een afweerreactie tegen de tumor hebben. Sommige van deze patiënten hebben bijvoorbeeld B-cellen die antistoffen maken tegen de (antigenen van) de tumor. Anderen hebben T-cellen specifiek tegen de tumor reageren. Sommige zowel T als B-cellen.
Celdodende T-cellen kunnen antigenen op tumorcellen herkennen en deze dan direct doden. Helper T-cellen kunnen tumoren indirect herkennen via antigeen presenterende cellen (de dendritische cellen), die in alle organen van het lichaam en zich meestal ook in en anders rond tumoren bevinden. Na herkenning van de tumor maken helper T-cellen cytokines die andere (afweer-)cellen stimuleren in hun functies.
Afhankelijk van het cytokine kunnen B-cellen worden gestimuleerd om antistoffen te maken, celdodende T-cellen worden gestimuleerd om tumoren te doden, of andere cellen worden gestimuleerd om de tumor of zijn bloedvaten te doden. In immune dieren die een effectieve afweer tegen een bepaalde tumor hebben wordt deze immuniteit meestal veroorzaakt door de verschillende T-cellen. Deze T-cellen circuleren met de bloed- en lymfestroom door alle weefsels, en herkennen specifiek tumorcellen. Ook antistoffen circuleren door alle weefsels. Recent onderzoek in proefdieren heeft aangetoond dat deze soms ook een bijdrage kunnen leveren voor immuniteit. Immune dieren stoten ook alle uitzaaiingen van dezelfde kanker af. Immuniteit tegen kanker is dus de meest ideale manier om de niet-operatief-verwijderbare uitzaaiingen op te ruimen.
Vaccin tegen kanker
Vaccinatie is het meest geteste middel om het afweersysteem te stimuleren. Tegen virussen en bacteriën is vaccinatie het meest effectieve middel. Hierbij wordt, vóór of op het moment van blootstelling, het afweersysteem gestimuleerd met dode of afgezwakte ziekteverwekkers of delen daarvan. Het afweersysteem reageert dan tegen die dode of afgezwakte vorm en wordt tegelijkertijd immuun tegen de echte ziekteverwekker.
In laboratoria wordt geprobeerd vaccins te maken tegen kanker. Meestal wordt dan geen gebruik gemaakt van de dode tumorcellen, maar van het RNA of peptiden (kleine stukjes eiwit) en tumor antigenen uit die kanker cellen. In de strijd tegen kanker worden de beste antigeen presenterende cellen (dendritische cellen) gebruikt, maar de resultaten zijn nog niet zoals gewenst.
Een nadeel van vaccinatie tegen ziekteverwekkers is dat het weinig effectief is in het geval van een al bestaande infectie. Een goed vaccin wordt preventief gegeven vóórdat blootstelling met de ziekteverwekkers plaatsvindt. Zodat je bij een besmetting niet ziek zult worden. Helaas is vaccinatie tegen spontane tumoren onmogelijk, gezien het feit dat er ontelbaar veel mogelijke tumor antigenen zijn.
Het gevaar van ongevaarlijk zijn
In de strijd tegen kanker worden de nieuwste methodes voor co-stimulatie gebruikt. Co-stimulatie is nodig voor de ontwikkeling van een goede afweer-respons, zonder co-stimulatie kan het lichaam zelfs actief tolerant worden tegen het vaccin. Co-stimulatie is nodig omdat het afweersysteem niet op alle lichaamsvreemde stoffen reageert. Neem bijvoorbeeld ons dagelijks voedsel en de meeste stoffen (stofdeeltjes uit de lucht) waarmee wij in aanraking komen. De enige uitzondering hierop zijn de stoffen waarvoor je allergisch bent!
Behalve dat een binnenkomend stofje lichaamsvreemd is, heeft het lichaam blijkbaar ook een signaal nodig dat aangeeft dat dit stofje ook daadwerkelijk gevaarlijk is. Het afweersysteem heeft twee methodes om ‘gevaar’ te zien. Schimmels, bacteriën en virussen worden herkend als ‘gevaar’ op grond van hun specifieke structuur door het lichaam (zie ‘Het ontstaan van specifieke afweer’). Omdat tumorcellen ontstaan uit lichaamscellen, hebben ze dergelijke specifieke structuren niet. Een tweede vorm van ‘gevaar’ zijn signalen die te maken hebben met schade in het lichaam. Bij schade in het lichaam kun je denken aan dode cellen, de aanwezigheid van vrije radicalen (instabiele en zeer agressief reagerende stoffen), en stress-eiwitten.
Beide vormen van ‘gevaar’ leiden tot de aanmaak van co-stimulerende moleculen op de antigeen-presenterende cellen, waardoor een goede afweer respons ontstaat. Uitzaaiende tumoren veroorzaken doorgaans veel schade waardoor ze makkelijker door lichaam opgemerkt worden. Maar jonge tumoren zijn vaak klein en veroorzaken weinig schade. De mogelijkheid bestaat dan dat de nog jonge tumor wel herkend wordt door het afweersysteem. Maar dat het afweersysteem ‘besluit’ dat de tumor beschermd moet worden, als ware het lichaamseigen. Het lichaam maakt dan T-cellen die weliswaar de tumor herkennen, maar afweerreacties daartegen remmen. Dit is weer een vorm van actieve tolerantie. Ofschoon latere co-stimulatie de tolerantie kan doorbreken, ligt het aan de krachtsverhouding tussen co-stimulatie en tolerantie of dit daadwerkelijk gebeurt.
Doorbreken van tolerantie
Een relatief eenvoudige en vaak effectieve manier om tolerantie te doorbreken is passief vaccineren, dat wil zeggen, antistoffen of T-cellen tegen de tumor in de patiënt spuiten. Studies in proefdieren laten zien dat tumor immune dieren dit meestal zijn vanwege de aanwezigheid van T-cellen. Helaas is het erg moeilijk om goed functionerende T-cellen op een effectieve manier buiten het lichaam te maken.
Antistoffen daarentegen kunnen tegenwoordig wel goed buiten het lichaam worden gemaakt met behulp van fagen. Fagen zijn virussen die bacteriën infecteren en zich daarin gemakkelijk laten vermeerderen. Deze fagen worden genetisch veranderd met alle mogelijk verschillende antistoffen die een mens kan maken. Zo’n faagbank, zoals dat genoemd wordt, kan uit wel 1011 verschillende fagen bestaan. Door vervolgens te selecteren op de fagen die wel aan de tumorcellen maar niet aan gewone cellen binden, kunnen in de reageerbuis menselijke antistoffen worden gemaakt die alleen aan de kankercellen binden.
Via moleculair biologische technieken kunnen van die fagen, menselijke antistoffen worden gemaakt opdat ze geschikt zijn om kankercellen te doden gebruikmakend van verschillende mogelijke natuurlijke afweermechanismen. Kleine delen van antistoffen gecombineerd met giftige of radioactieve stoffen kunnen beter in het weefsel doordringen dan volledige antistoffen. De antistoffragmenten zorgen dan dat de giftige of radioactieve stof in de tumor komt, waardoor deze selectief wordt gedood. Een derde strategie met antistoffen maakt gebruik van twee antistoffen die aan elkaar gekoppeld zijn, de ene bindt aan de tumor, de ander aan een cel die de tumor kan doden.
Aangezien antistoffen vaak geen belangrijke rol spelen bij de tumor immune proefdieren, is het niet duidelijk hoe effectief antistoffen in de strijd tegen kanker zijn. Misschien komt dit omdat vele antistoffen niet of slechts moeizaam in het tumorweefsel kunnen doordringen. Dat zou verklaren waarom antistoffen tezamen met cellulaire afweer (T-cellen) tot een betere afweer tegen kanker leiden dan de celdodende T-cellen alleen.
Uithongeren
Een andere manier om kanker te bestrijden is indirect, namelijk door het vernietigen van de voedsel- en zuurstof aanvoer van het gezwel. Voedsel en zuurstof wordt aangevoerd via de bloedvaten, die in tumoren jonger en anders zijn dan in normaal weefsel. Daarom zijn deze bloedvaten gevoeliger voor aanvallen van het afweersysteem. De bloedtoevoer naar tumoren kan worden gesaboteerd door de bloedvatwanden te vernietigen, de aanmaak van bloedvaten te remmen, de bloedsomloop te stoppen door stolling, of de uitwisseling van stoffen met het omringende weefsel te verhinderen door het veroorzaken van tegendruk in het weefsel (oedeem). De meeste therapieën richten zich vooralsnog op de eerste twee strategieën.
Tumor bloedvatwanden (endotheel) worden vernietigd met behulp van antistoffen. Cytokines die de aanmaak van bloedvaten remmen, worden met succes gebruikt in proefdieren, maar nog niet in patiënten. Het vernietigen van de bloedaanvoer kan een effectief middel zijn tegen grote en middelgrote tumoren die afhankelijk zijn van tumorbloedvaten. Kleine uitzaaiingen, die niet afhankelijk zijn van tumorbloedvaten, worden echter niet gedood bij deze therapie, waardoor de tumor slechts ten dele wordt opgeruimd. Misschien dat een combinatie van anti-bloedvat therapie en antistoffen tegen de tumor effectiever is.
Sturen van het afweersysteem
Cytokines zijn het communicatiemiddel tussen cellen van het afweersysteem onderling. Cytokine-therapie (het toedienen van specifieke cytokines) is de meest voor de hand liggende aanpak als je de toonzetting van de afweer wilt veranderen. Sommige cytokines kunnen aanzetten tot het direct doden van cellen, andere tot het maken van specifieke afweercellen, weer andere tot de productie van antistoffen en nog weer andere tot tolerantie. Met toedienen van cytokines kan het afweersysteem worden gestuurd.
Het afweersysteem heeft verschillende manieren om tumoren op te ruimen, de ene methode is effectiever dan de andere. Hoewel antistoffen een bijdrage kunnen leveren aan het doden van tumor cellen, denken de meeste wetenschappers dat de beste afweer tegen tumoren de cellulaire afweer betreft. Cellulaire afweer bestaat voornamelijk uit helper T-cellen en celdodende T-cellen. Deze afweer ontstaat in een zogenaamd type 1 cytokine milieu, terwijl een type 2 cytokine milieu antistofproductie bevordert (zie afbeelding 1).
Voor het sturen van beginnende afweerreacties zijn kleine hoeveelheden cytokines nodig, en nadat een afweerreactie is begonnen worden dezelfde cytokines in grotere hoeveelheden gemaakt om de afweerreactie in stand te houden. In geval van een bestaande tumor is er meestal al een afweerreactie in een bepaalde richting. Zo’n afweerreactie houdt zichzelf in stand met de productie van bepaalde cytokines. Door die sturende cytokines kan de afweerreacties meestal niet meer worden veranderd, zelfs niet door het toedienen van grotere hoeveelheden andere cytokines.
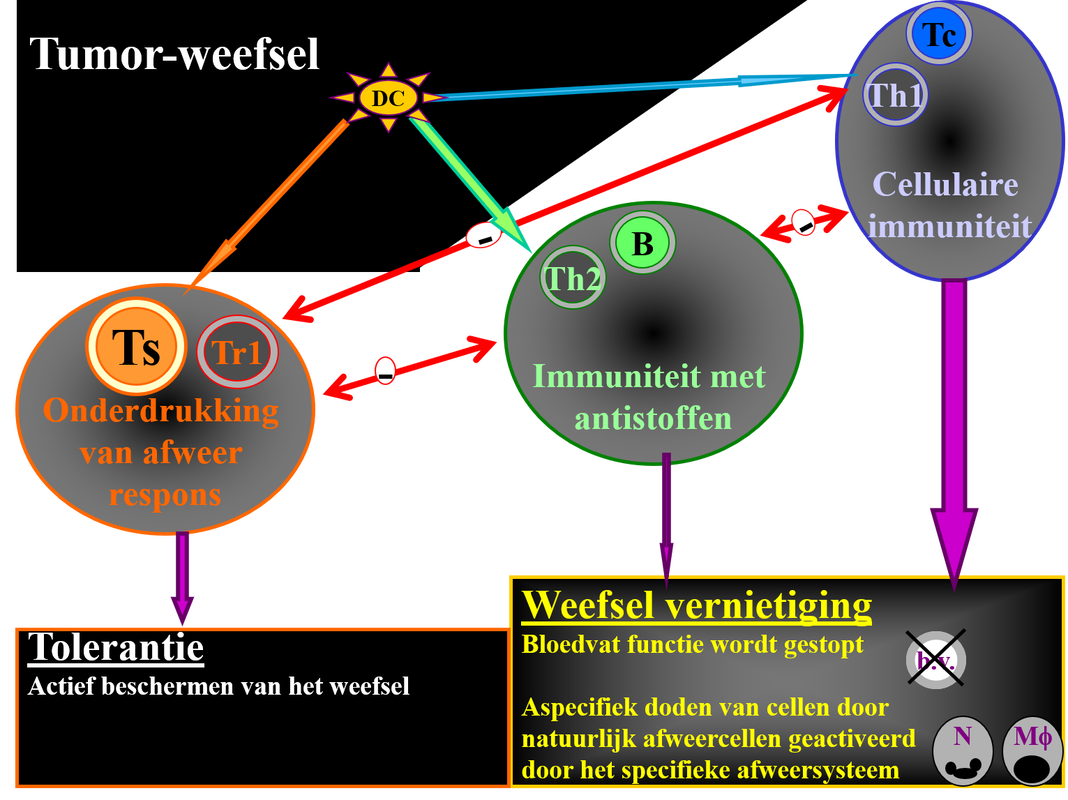
Afb. 2: De wisselwerking tussen tumor en afweersysteem:
De dendritische cel (DC) in de tumor neemt tumor antigenen op. Vervolgens kan deze op drie manieren het afweersysteem aanzetten.Ten eerste (volg blauwe lijn) kan de cellulaire afweer worden aangezet. In dit geval worden type 1 cytokines gemaakt door de helper T-cellen (Th1). Th1 cellen stimuleren de vorming van cytotoxische (celdodende) T-cellen (Tc). Deze Tc kunnen de tumorcellen doden. Ten tweede (volg groene lijn) kan de antistofproductie worden aangezet. Eerst worden type 2 cytokines gemaakt door de helper T-cellen (Th2). Deze cytokines stimuleren de aanmaak van antistoffen door B-cellen (B). De antistoffen (die in het bloed en de weefselvloeistof terechtkomen) kunnen de tumorcellen doden, maar zijn daarin niet het meest actief. Behalve het aanzetten tot direct doden kunnen de cytokines van Th1- , Th2- en Tc- cellen zorgen dat bloedvaten (b.v.) niet meer functioneel zijn, of dat cellen van het natuurlijke afweersysteem (N = neutrofiele granulocyt; Mf = macrofaag) de tumor doden. Dit is de meest efficiënte manier om een tumor te doden. De derde mogelijkheid (volg oranje lijn) is dat helper T-cellen de afweerreactie gaan beperken en regulerende T-cellen worden (Tr1). Deze Tr1 zorgen voor de aanmaak van afweeronderdrukkende suppressie T-cellen (Ts), waardoor een actieve vorm van tolerantie ontstaat en de tumor beschermt wordt door het afweersysteem. De drie verschillende mogelijke afweerreactie remmen elkaar in functie, hetgeen aangegeven is met de rode lijnen met een minnetje erin.
De dendritische cel (DC) in de tumor neemt tumor antigenen op. Vervolgens kan deze op drie manieren het afweersysteem aanzetten.Ten eerste (volg blauwe lijn) kan de cellulaire afweer worden aangezet. In dit geval worden type 1 cytokines gemaakt door de helper T-cellen (Th1). Th1 cellen stimuleren de vorming van cytotoxische (celdodende) T-cellen (Tc). Deze Tc kunnen de tumorcellen doden. Ten tweede (volg groene lijn) kan de antistofproductie worden aangezet. Eerst worden type 2 cytokines gemaakt door de helper T-cellen (Th2). Deze cytokines stimuleren de aanmaak van antistoffen door B-cellen (B). De antistoffen (die in het bloed en de weefselvloeistof terechtkomen) kunnen de tumorcellen doden, maar zijn daarin niet het meest actief. Behalve het aanzetten tot direct doden kunnen de cytokines van Th1- , Th2- en Tc- cellen zorgen dat bloedvaten (b.v.) niet meer functioneel zijn, of dat cellen van het natuurlijke afweersysteem (N = neutrofiele granulocyt; Mf = macrofaag) de tumor doden. Dit is de meest efficiënte manier om een tumor te doden. De derde mogelijkheid (volg oranje lijn) is dat helper T-cellen de afweerreactie gaan beperken en regulerende T-cellen worden (Tr1). Deze Tr1 zorgen voor de aanmaak van afweeronderdrukkende suppressie T-cellen (Ts), waardoor een actieve vorm van tolerantie ontstaat en de tumor beschermt wordt door het afweersysteem. De drie verschillende mogelijke afweerreactie remmen elkaar in functie, hetgeen aangegeven is met de rode lijnen met een minnetje erin.
Opzwepen van het afweersysteem
Het eerst-gebruikte anti-kanker cytokine (als medicijn) is Interleukine-2 (IL-2) en wordt al sinds de 80-er jaren gebruikt. IL-2 stimuleert verschillende typen cellen die tumoren doden. Een ander bekend voorbeeld is Tumor Necrose Factor alfa (TNF-alfa), een stof bekend om zijn dodelijke werking voor cellen. Het nadeel van cytokines is dat ze het hele afweersysteem regelen en vele verschillende cellen beïnvloeden, waardoor cytokines nogal wat bijwerkingen vertonen. TNF-alfa is reeds in zeer lage dosis giftig voor vele cellen.
IL-2 veroorzaakt in patiënten lekkage van de bloedvaten, waardoor een dodelijk lage bloeddruk kan ontstaan. IL-2 kan Natural killer (NK) cellen stimuleren, in hun natuurlijke afweer tegen tumoren en bevordert ook de vorming van specifieke T-cellen. Een mogelijke oplossing is om NK-cellen in een reageerbuis met cytokines te behandelen, alvorens ze terug te geven aan de patiënt. Het therapeutisch effect hiervan is echter gering, omdat de activiteiten van IL-2 om T-cellen te stimuleren hierbij niet worden gebruikt.
Krabben waar het jeukt
Gezien de veelvoud van acties zijn cytokines een interessante methode voor anti-kanker therapie, indien de bijwerkingen verminderd kunnen worden. Een mogelijkheid om dat te doen is de cytokines lokaal toe te dienen waar ze nodig zijn, dus in of in de buurt van de tumor. Dit heeft als voordeel dat de concentratie cytokines in de tumor hoog blijft, maar dat de bijwerkingen sterk worden teruggedrongen. In een operatie kan de bloedstroom door de tumor voorzien worden van TNF-alfa, zonder dat deze bloedstroom door het gehele lichaam gaat. TNF-alfa geeft dan een sterke vermindering van de tumorgrootte. Als IL-2 in of nabij een gezwel word geïnjecteerd kunnen tumoren met een grootte tot 5% van het lichaamsgewicht verdwijnen.
Opmerkelijk genoeg, verdwijnt niet alleen het gezwel waar IL-2 is ingespoten, maar ook de uitzaaiingen hiervan. Lokale IL-2 therapie werkt bij verschillende proefdiermodellen, maar wordt ook succesvol toegepast bij patiënten. Oogtumoren van runderen en blaastumoren van mensen kunnen effectief bestreden worden met lokale IL-2 met goede genezingspercentages. Uit proefdierexperimenten blijkt dat genezen dieren na lokale IL-2 therapie immuun zijn voor dat type kanker, maar niet voor anderen. Helaas werkt lokale IL-2 therapie nog niet voor alle soorten kanker en is ook de timing van toediening belangrijk. Om deze en andere therapieën te verbeteren is nog wel wat onderzoek vereist.
Verbetering van anti-kanker therapie
Een aantal afweerstimulerende therapieën toont voor sommige tumoren goede resultaten. De veelvoud van cellen in het afweersysteem en hun onderlinge interacties en interacties met de tumor, maken het onmogelijk het gehele onderzoek in de reageerbuis te doen. Vandaar dat nieuwe geneesmiddelen of toedieningsmethodes op dieren of mensen moeten worden uitgetest, in proefdieren of zieke dieren en mensen.
In de Verenigde Staten is het voldoende om aan te tonen dat een middel niet giftig is voor de patiënt; vervolgens worden mensen als proefdieren gebruikt. Voordat een nieuw geneesmiddel tegen kanker in Nederland op menselijke patiënten mag worden getest, moeten de therapie resultaten van dieren onder vergelijkbare omstandigheden met vergelijkbare tumoren bekend zijn. Hiermee voorkomt Nederland dat menselijke patiënten gebruikt worden als proefkonijn voor medicijnen die waarschijnlijk toch niet werken. De weg van succesvolle laboratoriumproeven naar geneesmiddel kan gemakkelijk 15 tot 20 jaar beslaan.
Bronnen:
- J. G. van den Tweel e.a. Immunologie. Het menselijk afweersysteem. (1988) (uitgave van Natuur & Techniek).
- Maas, R., Dulens, H. F. J., De Jong W. H. & Den Otter, W., (1989) Immunotherapy of mice with a large burden of disseminated lymphoma with low-dose interleukin-2, Cancer Res. 49: 8037
- Den Otter, W., Steerenberg, P. A. & Van der Laan, J-W (2002) Testing therapeutic potency of anticancer drugs in animal studies: a commentary. Regulatory Toxicol. Pharmacol. 35: 266-272 (2002)
Auteur

Dit artikel is geschreven door John Jacobs in samenwerking met het NIBI, Nederlands Instituut voor Biologie.