COVID-19
Bijzondere immuniteit
John Jacobs, 6 maart 2021.
Luchtwegvirussen hebben een relatie met het afweersysteem dat vol paradoxen zit. Aan het begin van de infecties hebben mensen veel virus (hoge virustiters), maar zijn ze minder ziek door minder afweerrespons. Mensen die zieker worden, worden dat vooral door hun afweer tegen het virus. Luchtweginfecties kennen een bijzondere immunologie. SARS-2 trekt die uitzondering zelfs in het extreme: fatale ziekte komt door een verkeerde en te sterke afweerreactie. Daarom is het goed om een aantal verschillende componenten van de afweer en hun rollen te onderscheiden:
- Algemene afweer. De natuurlijke weerstand van gezond weefsel dat schadelijke virussen en bacteriën in een vroeg stadium aanpakt. Dit is ook het systeem waardoor je ziek wordt.
- Vroege antistoffen (IgM). Antistoffen in de circulatie die tijdelijk aanwezig zijn en beperkt effectief zijn, omdat ze niet zo sterk zijn.
- Gewone antistoffen (IgG). Antistoffen in de circulatie die het virus direct kunnen neutraliseren en/of bepaalde afweercellen het virus kunnen laten opeten. Dat laatste kan soms ook leiden tot infectie van die afweercellen. Opvallend is dat mensen met meer antistoffen zieker zijn (Figuur 1). Dat suggereert dat antistoffen niet alleen een beschermende werking hebben, maar ook een rol spelen in de ziekte.
- Slijmvliesantistoffen (IgA). Antistoffen die buiten de gewone circulatie in de slijmvliezen komen van de luchtwegen en het maagdarmstelsel, waar andere antistoffen niet komen. Deze antistoffen zijn noodzakelijk om te voorkomen dat iemand geïnfecteerd en besmettelijk kan worden - steriliserende immuniteit genaamd.
- Celdodende T-cellen. Cytotoxische CD8 T cellen die geïnfecteerde cellen kunnen opruimen en daarmee voorkomen dat veel nieuw virus vrijkomt.
- Helper T-cellen. CD4 cellen die hulp bieden aan CD8 T-cellen en/of B-cellen. Voor B-cellen is dit nodig om IgG en IgA te kunnen maken.
Figuur 1. Antistofgeheugen na COVID-19.
Hoe werkt afweer tegen SARS-2
Een efficiënte lokale eerstelijnsreactie met type 1 interferon (α, β) voorkomt infectie in een vroeg stadium. De meeste mensen met milde infectie met SARS-2 hebben zowel neutraliserende antistoffen als T-cel responsen.
Wanneer worden mensen ernstig ziek? Mensen met goede T-cel responsen worden zelden ernstig ziek. Mensen met slechte T-cel responsen, zoals bij veel oudere mensen, kunnen ernstig ziek worden, maar dat gebeurt niet altijd. Mensen met slechte T-cel responsen die bepaalde sterke antistofresponsen hebben ernstig ziek. Mogelijk is een vorm van neutraliserende antistoffen verantwoordelijk. Antistoffen kunnen ook voorkomen dat het virus cellen infecteert. T-cel responsen kunnen worden opgedeeld in CD4 en CD8. CD8 cellen zijn cytotoxische T-cellen de afweer van het lichaam tegen virus-geïnfecteerde cellen. CD4 T cellen coördineren de afweerreactie voor B-cellen met antistoffen of CD8 cytotoxische T cellen. IgA antistoffen kunnen steriliserende immuniteit geven.
Hoge aantallen CD4 en/of CD8 T-cellen beschermen tegen ziekte. Dit illustreert dat, net als bij de meeste virusinfecties, o.a. influenza, de cellulaire immuniteit de belangrijkste bescherming tegen ziekte biedt. Cellulaire immuniteit ruimt echter geen vrij virus op en circuleert normaal niet in epitheliale weefsels, dus het zal nooit steriliserende immuniteit opleveren.
Hoge IgG antistoftiters zijn geen probleem bij personen die nog niet geïnfecteerd zijn, omdat de IgG antistoffen dan de symptomatische infectie lijken te voorkomen. Als IgG antistoffen nog gemaakt moeten worden zijn te laat. De hypothese dat antistoffen de ziekte kunnen verergeren door de ontstekingsreactie te versterken en het virus te verspreiden antistof-gemedieerde infectie van myeloïde bloedcellen is niet onwaarschijnlijk.
Antigeen-specifieke immuniteit voor besmetting voorkomt ziekte, maar geen infectie. De T-cellen en IgG of IgM antistoffen komen niet in de epitheliale weefsels buiten het basaalmembraan. Alleen IgA antistoffen kunnen steriliserende immuniteit veroorzaken. IgG antistoffen blijven meer dan een half jaar.
Wanneer worden mensen ernstig ziek? Mensen met goede T-cel responsen worden zelden ernstig ziek. Mensen met slechte T-cel responsen, zoals bij veel oudere mensen, kunnen ernstig ziek worden, maar dat gebeurt niet altijd. Mensen met slechte T-cel responsen die bepaalde sterke antistofresponsen hebben ernstig ziek. Mogelijk is een vorm van neutraliserende antistoffen verantwoordelijk. Antistoffen kunnen ook voorkomen dat het virus cellen infecteert. T-cel responsen kunnen worden opgedeeld in CD4 en CD8. CD8 cellen zijn cytotoxische T-cellen de afweer van het lichaam tegen virus-geïnfecteerde cellen. CD4 T cellen coördineren de afweerreactie voor B-cellen met antistoffen of CD8 cytotoxische T cellen. IgA antistoffen kunnen steriliserende immuniteit geven.
Hoge aantallen CD4 en/of CD8 T-cellen beschermen tegen ziekte. Dit illustreert dat, net als bij de meeste virusinfecties, o.a. influenza, de cellulaire immuniteit de belangrijkste bescherming tegen ziekte biedt. Cellulaire immuniteit ruimt echter geen vrij virus op en circuleert normaal niet in epitheliale weefsels, dus het zal nooit steriliserende immuniteit opleveren.
Hoge IgG antistoftiters zijn geen probleem bij personen die nog niet geïnfecteerd zijn, omdat de IgG antistoffen dan de symptomatische infectie lijken te voorkomen. Als IgG antistoffen nog gemaakt moeten worden zijn te laat. De hypothese dat antistoffen de ziekte kunnen verergeren door de ontstekingsreactie te versterken en het virus te verspreiden antistof-gemedieerde infectie van myeloïde bloedcellen is niet onwaarschijnlijk.
Antigeen-specifieke immuniteit voor besmetting voorkomt ziekte, maar geen infectie. De T-cellen en IgG of IgM antistoffen komen niet in de epitheliale weefsels buiten het basaalmembraan. Alleen IgA antistoffen kunnen steriliserende immuniteit veroorzaken. IgG antistoffen blijven meer dan een half jaar.
Algemene afweer
Coronavirussen zorgen voor seizoensgebonden infecties en ziekte in gematigde gebieden: verkoudheid. In tropische gebieden veroorzaken ze het hele jaar door verkoudheid. Infectie gaat echter effectiever met meer ziekte in de winter en lente. Dat komt door:
De algemene afweer levert zelf geen immuniteit op de volgende keer wordt iemand net zo ziek, tenzij specifieke afweer is ontwikkeld. De algemene afweer stuurt de richting van de specifieke immuniteit, zoals T-cellen en/of verschillende antistoffen.
Ongeacht het jaargetijden is type 1 interferon (α, β) een belangrijke verdediging van cellen tegen virusinfectie. Het afweersysteem kent veel feedbackloops en bij sommige mensen is de Interferon β response geblokkeerd. Dit leidt tot ernstigere ziekte. Algemene of natuurlijke afweer in de slijmvliezen speelt een cruciale rol in het voorkomen van de ziekte en het minimaliseren van de infectie. In de eerste weken na een virusinfectie of vaccinatie worden type 1 interferon gemaakt. Interferon wordt gemaakt door vrijwel alle lichaamscellen na contact met een virus. Dus ook bij geïnactiveerd virus uit vaccins.
Interferon is effectief tegen SARS-2, maar het virus remt de productie van interferon, waardoor een cruciaal evenwicht ontstaat. Jonge mensen die een van de meerdere vormen van interferon missen, kennen meestal geen zwakkere gezondheid, maar lopen een reële kans op overlijden door COVID-19.
- Lage temperatuur zorgt voor stabiliteit van het virus.
- Koude en droge lucht maakt de slijmvliezen gevoeliger.
- Vitamine D niveaus zijn lager in de winter, omdat de huid deze maakt onder invloed van de zon. Vitamine D is op veel manieren betrokken bij de infectie in de winter, bij ouderen of mensen met een donkere huid. Vitamine D3 tabletten (aanbevolen dagelijkse hoeveelheid!) wordt geadviseerd om luchtweg RNA virus infecties te voorkomen – daar vallen ook de coronavirussen onder. Voldoende vitamine D status is belangrijk om de ziekte te voorkomen.
- Luchtvervuiling is een belangrijke cofactor voor infectie en ziekte doordat de irritatie de slijmvliezen aantast en kwetsbaarder maakt en algemene ontsteking verergerd, zonder het virus specifiek aan te pakken.
De algemene afweer levert zelf geen immuniteit op de volgende keer wordt iemand net zo ziek, tenzij specifieke afweer is ontwikkeld. De algemene afweer stuurt de richting van de specifieke immuniteit, zoals T-cellen en/of verschillende antistoffen.
Ongeacht het jaargetijden is type 1 interferon (α, β) een belangrijke verdediging van cellen tegen virusinfectie. Het afweersysteem kent veel feedbackloops en bij sommige mensen is de Interferon β response geblokkeerd. Dit leidt tot ernstigere ziekte. Algemene of natuurlijke afweer in de slijmvliezen speelt een cruciale rol in het voorkomen van de ziekte en het minimaliseren van de infectie. In de eerste weken na een virusinfectie of vaccinatie worden type 1 interferon gemaakt. Interferon wordt gemaakt door vrijwel alle lichaamscellen na contact met een virus. Dus ook bij geïnactiveerd virus uit vaccins.
Interferon is effectief tegen SARS-2, maar het virus remt de productie van interferon, waardoor een cruciaal evenwicht ontstaat. Jonge mensen die een van de meerdere vormen van interferon missen, kennen meestal geen zwakkere gezondheid, maar lopen een reële kans op overlijden door COVID-19.
Specifieke afweer
Specifieke afweer bestaat uit T-cellen en antistoffen geproduceerd door B-cellen. Veel studies meten antistoffen, zonder te kijken naar cellulaire immuniteit. Het is waarschijnlijk dat mensen met antistoffen in aanraking zijn geweest met het virus of een vaccin tegen het virus, waardoor ze ook T-cellen hebben tegen het virus. Omdat dit niet in de studies staat zijn deze lastig te interpreteren. Ondanks verhoogde afweer zijn niet alle mensen beschermd tegen een herinfectie. De bescherming tegen ziekte is groter dan de bescherming tegen infectie.
T cellen zijn verantwoordelijk voor de cellulaire afweer. T cel immuniteit tegen COVID-19 is sterk, vooral de CD8 respons na milde infectie. Na infecties neemt het aantal T-cellen af, waarbij wetenschappers kijken naar de tijd dat het aantal halveert. Er zijn enkele verschillen tussen studies. CD4 T cellen hebben een halveringstijd van 3 tot 7 maanden. CD8 T-cellen van 4 tot 9 maanden. Bij een zesde en een kwart van de mens kunnen CD4 en CD8 T cel cytokine responsen na 9 maanden niet meer worden aangetoond. Het is niet duidelijk hoeveel T cel respons iemand moet hebben om immuun te zijn.
Studies bij verkoudheid virussen laten zien dat antistoftiters stijgen na infectie met een maximum voor IgG en IgA na ongeveer 3 weken na infectie. Het duurt gemiddeld 5 dagen voordat iemand ziek wordt en vervolgens gemiddeld 13 dagen voordat IgG antistoffen worden gemaakt. Op dag 19 na begin van de symptomen heeft iedereen IgG antistoffen. Van andere (corona)virussen weten we dat IgA enkele dagen later volgt. Antistoffen nemen af na de ziekte, vooral bij IgA is de afname sterk.
T cellen zijn verantwoordelijk voor de cellulaire afweer. T cel immuniteit tegen COVID-19 is sterk, vooral de CD8 respons na milde infectie. Na infecties neemt het aantal T-cellen af, waarbij wetenschappers kijken naar de tijd dat het aantal halveert. Er zijn enkele verschillen tussen studies. CD4 T cellen hebben een halveringstijd van 3 tot 7 maanden. CD8 T-cellen van 4 tot 9 maanden. Bij een zesde en een kwart van de mens kunnen CD4 en CD8 T cel cytokine responsen na 9 maanden niet meer worden aangetoond. Het is niet duidelijk hoeveel T cel respons iemand moet hebben om immuun te zijn.
Studies bij verkoudheid virussen laten zien dat antistoftiters stijgen na infectie met een maximum voor IgG en IgA na ongeveer 3 weken na infectie. Het duurt gemiddeld 5 dagen voordat iemand ziek wordt en vervolgens gemiddeld 13 dagen voordat IgG antistoffen worden gemaakt. Op dag 19 na begin van de symptomen heeft iedereen IgG antistoffen. Van andere (corona)virussen weten we dat IgA enkele dagen later volgt. Antistoffen nemen af na de ziekte, vooral bij IgA is de afname sterk.
Linksom of rechtsom denken
Ooit begon iemand een college over analyse met vliegtuigen die beschoten waren en terugkeerden van bombardementen. De gangbare hypothese was dat de vliegtuigen versterkt moesten worden op de plekken waar kogelgaten zaten. Iemand zag het anders en kwam met de hypothese dat vliegtuigen juist beschermd moesten worden op de plekken waar geen gaten zaten. Zijn betoog luidde dat alle gaten die gevonden waren, de vliegtuigen niet belemmerd hadden om terug te keren. Dit verhaal kwam als een flashback terug toen ik de RIVM-uitleg hoorde van antistoffen bij COVID-19.
Van Dissel en enkele andere wetenschappers stellen dat mensen met milde klachten minder antistoffen maken en dus minder immuun worden. Mensen met weinig of geen symptomen hebben weinig of geen neutraliserende antistoffen tegen SARS-2. Oude mensen hebben hogere antistoftiters dan jonge mensen. Mensen die opgenomen worden in het ziekenhuis hebben 10 tot 30 keer zoveel antistoffen dan mensen die thuis kunnen uitzieken. Kinderen worden even vaak geïnfecteerd en scheiden even vaak virus uit, maar zijn minder vaak (ernstig) ziek en hebben minder vaak antistoffen volgens het RIVM.
De WHO zegt terecht dat “geen enkele studie heeft laten zien dat antistoffen tegen SARS-CoV-2 bescherming bieden tegen nieuwe infectie met dit virus in mensen.” Een effectieve algemene afweer kan voorkomen dat iemand geïnfecteerd en ziek wordt, maar als het virus doorbreekt moet de virus-specifieke immuniteit in actie komen. Deze bestaat uit twee hoofdvormen: antistoffen en cellulaire afweer. Sterke afweerreacties worden gezien bij ernstige ziekte. Klaarblijkelijk zijn mensen met een matige antistofreactie toch in staat zijn om te voorkomen dat ze ernstig ziek worden. Waarschijnlijk is dit door cellulaire afweer.
De wetenschappelijke discussie is of hoge antistofconcentraties in ernstig zieke patiënten de oorzaak zijn van de ernstige ziekte, het gevolg zijn, of juist de patiënten beschermen tegen ziekte. Het eerste komt overeen met het verschijnsel van virus-immuunpathologie. Het tweede biedt geen verklaring voor de functie van antistoffen. Het laatste is strijdig met de fatale ziekte die gepaard gaat met hoge antistoftiters. Mensen die goed beschermd zijn overlijden niet door een ziekte. Dit zijn voor mij de belangrijkste redenen om het eerste te vermoeden.
Van Dissel en enkele andere wetenschappers stellen dat mensen met milde klachten minder antistoffen maken en dus minder immuun worden. Mensen met weinig of geen symptomen hebben weinig of geen neutraliserende antistoffen tegen SARS-2. Oude mensen hebben hogere antistoftiters dan jonge mensen. Mensen die opgenomen worden in het ziekenhuis hebben 10 tot 30 keer zoveel antistoffen dan mensen die thuis kunnen uitzieken. Kinderen worden even vaak geïnfecteerd en scheiden even vaak virus uit, maar zijn minder vaak (ernstig) ziek en hebben minder vaak antistoffen volgens het RIVM.
De WHO zegt terecht dat “geen enkele studie heeft laten zien dat antistoffen tegen SARS-CoV-2 bescherming bieden tegen nieuwe infectie met dit virus in mensen.” Een effectieve algemene afweer kan voorkomen dat iemand geïnfecteerd en ziek wordt, maar als het virus doorbreekt moet de virus-specifieke immuniteit in actie komen. Deze bestaat uit twee hoofdvormen: antistoffen en cellulaire afweer. Sterke afweerreacties worden gezien bij ernstige ziekte. Klaarblijkelijk zijn mensen met een matige antistofreactie toch in staat zijn om te voorkomen dat ze ernstig ziek worden. Waarschijnlijk is dit door cellulaire afweer.
De wetenschappelijke discussie is of hoge antistofconcentraties in ernstig zieke patiënten de oorzaak zijn van de ernstige ziekte, het gevolg zijn, of juist de patiënten beschermen tegen ziekte. Het eerste komt overeen met het verschijnsel van virus-immuunpathologie. Het tweede biedt geen verklaring voor de functie van antistoffen. Het laatste is strijdig met de fatale ziekte die gepaard gaat met hoge antistoftiters. Mensen die goed beschermd zijn overlijden niet door een ziekte. Dit zijn voor mij de belangrijkste redenen om het eerste te vermoeden.
Bittere of zoete antistoffen?
Veel studies bestuderen alleen antistoffen omdat dit technisch veel eenvoudiger is. Hoge of lage antistoftiters zeggen echter niets over de hoeveelheid of effectiviteit van T-cel responsen. Als een van beide of allebei nodig zijn voor effectief opruimen van het virus, levert het bestuderen van alleen de antistoffen slechts beperkte informatie. Vrijwel alle mensen die geïnfecteerd en ziek zijn hebben antistoffen tegen SARS-2, maar van de mensen die geïnfecteerd zijn en geen klachten hebben heeft slechts 1 van de 5 antistoffen.
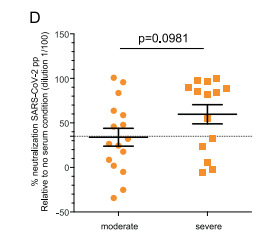
Een sterke afweerreactie met veel antistoffen voorspelt een ernstige ziekte met vaker een slechte afloop (Figuur 2). Hoge titers van neutraliserende antistoffen correleren positief met hoge ontstekingswaardes (CRP) en negatief met het aantal witte bloedcellen. Oude mensen hebben vaak hoge titers van neutraliserende antistoffen dan jonge patiënten. Dit kan het begin zijn van sepsis, de afweerreactie door het gehele lichaam waar SARS-2 patiënten door overlijden.
De correlatie antistoffen met ziekte en fatale afloop is opmerkelijk omdat het gaat om neutraliserende antistoffen tegen het Spike-eiwit die ook door vaccins worden geïnduceerd. Bij andere coronavirussen zijn mensen met veel antistoffen waarschijnlijk beter tegen herinfectie, en het is niet onwaarschijnlijk dat dit ook voor SARS-2 geldt. Tijdens ziekte geldt echter iets anders dan in gezonde mensen voordat ze ziek worden.
Het afweersysteem van sommige mensen reageert zwak op het virus en deze mensen kunnen lang geïnfecteerd blijven met hoge virustiters, zonder ernstige ziekte. Zoals bij de meeste luchtwegvirussen is ziek worden vooral het gevolg van de afweerreactie tegen het virus, niet of nauwelijks van het virus zelf. Om het moment dat mensen ziek worden hebben ze al hoge virustiters en die dalen vrij snel na het begin van de eerste symptomen.
Fucose is een suikergroep die aan het constante deel van de meeste antistoffen bindt. Coronapatiënten die op de Intensive Care belanden, maken antistoffen zonder de suikergroep fucose – niet-gefucosyleerde antistoffen tegen SARS-2. De afwezigheid van deze suikergroep is een verschil met de antistoffen bij mensen met milde klachten. Deze suikerarme antistoffen zorgen voor een extreem krachtige, schadelijke afweerreactie. CD16 is betrokken bij antistof-gemedieerde endocytose, ook van virussen, in onder andere mestcellen, macrofagen en natural killer cellen. In deze endocytose eten afweercellen het virus op dankzij antistoffen die binden aan het virus. Bij de ontwikkeling van SARS-2 vaccins is men hier alert op, omdat dit proces voor enkele coronavirussen is beschreven. Het lijkt vooralsnog bij vaccinatie geen belangrijke rol te spelen.
Normaal is ongeveer 6% van het IgG niet-gefucosyleerd, maar sommige mensen hebben meer suikerarme antistoffen tegen coronavirussen en andere virussen met een membraan. Niet-gefucosyleerd IgG bindt sterker aan Fc-receptoren (FcγRIIIa; CD16). CD16 activatie door antistoffen versterken cytokine response en zijn betrokken bij de amplificatie van de afweerreactie door antigeen-antistofcomplex allergie reacties. De cytokinestorm of sepsis in SARS-2 is het mechanisme waardoor SARS-2 mogelijk fataal wordt. De vroege hypothese dat neutraliserende antistoffen mogelijk de oorzaak zijn van virus-immuun-pathologie is daarmee verfijnd naar suikerarme neutraliserende antistoffen, maar zeker nog niet afgeschreven. Hoewel veel patiënten met verminderde cellulaire afweer kwetsbaarder zijn voor overlijden door COVID-19, krijgen mensen die geen antistoffen kunnen maken juist een mildere ziekte. Het lijkt nu dat vooral de hoge niveaus niet-gefucosyleerd IgG de boosdoener is.
Een sterke afweerreactie met veel antistoffen voorspelt een ernstige ziekte met vaker een slechte afloop (Figuur 2). Hoge titers van neutraliserende antistoffen correleren positief met hoge ontstekingswaardes (CRP) en negatief met het aantal witte bloedcellen. Oude mensen hebben vaak hoge titers van neutraliserende antistoffen dan jonge patiënten. Dit kan het begin zijn van sepsis, de afweerreactie door het gehele lichaam waar SARS-2 patiënten door overlijden.
De correlatie antistoffen met ziekte en fatale afloop is opmerkelijk omdat het gaat om neutraliserende antistoffen tegen het Spike-eiwit die ook door vaccins worden geïnduceerd. Bij andere coronavirussen zijn mensen met veel antistoffen waarschijnlijk beter tegen herinfectie, en het is niet onwaarschijnlijk dat dit ook voor SARS-2 geldt. Tijdens ziekte geldt echter iets anders dan in gezonde mensen voordat ze ziek worden.
Het afweersysteem van sommige mensen reageert zwak op het virus en deze mensen kunnen lang geïnfecteerd blijven met hoge virustiters, zonder ernstige ziekte. Zoals bij de meeste luchtwegvirussen is ziek worden vooral het gevolg van de afweerreactie tegen het virus, niet of nauwelijks van het virus zelf. Om het moment dat mensen ziek worden hebben ze al hoge virustiters en die dalen vrij snel na het begin van de eerste symptomen.
Fucose is een suikergroep die aan het constante deel van de meeste antistoffen bindt. Coronapatiënten die op de Intensive Care belanden, maken antistoffen zonder de suikergroep fucose – niet-gefucosyleerde antistoffen tegen SARS-2. De afwezigheid van deze suikergroep is een verschil met de antistoffen bij mensen met milde klachten. Deze suikerarme antistoffen zorgen voor een extreem krachtige, schadelijke afweerreactie. CD16 is betrokken bij antistof-gemedieerde endocytose, ook van virussen, in onder andere mestcellen, macrofagen en natural killer cellen. In deze endocytose eten afweercellen het virus op dankzij antistoffen die binden aan het virus. Bij de ontwikkeling van SARS-2 vaccins is men hier alert op, omdat dit proces voor enkele coronavirussen is beschreven. Het lijkt vooralsnog bij vaccinatie geen belangrijke rol te spelen.
Normaal is ongeveer 6% van het IgG niet-gefucosyleerd, maar sommige mensen hebben meer suikerarme antistoffen tegen coronavirussen en andere virussen met een membraan. Niet-gefucosyleerd IgG bindt sterker aan Fc-receptoren (FcγRIIIa; CD16). CD16 activatie door antistoffen versterken cytokine response en zijn betrokken bij de amplificatie van de afweerreactie door antigeen-antistofcomplex allergie reacties. De cytokinestorm of sepsis in SARS-2 is het mechanisme waardoor SARS-2 mogelijk fataal wordt. De vroege hypothese dat neutraliserende antistoffen mogelijk de oorzaak zijn van virus-immuun-pathologie is daarmee verfijnd naar suikerarme neutraliserende antistoffen, maar zeker nog niet afgeschreven. Hoewel veel patiënten met verminderde cellulaire afweer kwetsbaarder zijn voor overlijden door COVID-19, krijgen mensen die geen antistoffen kunnen maken juist een mildere ziekte. Het lijkt nu dat vooral de hoge niveaus niet-gefucosyleerd IgG de boosdoener is.
Rijping immuniteit en mutaties
Antistoffen worden beter door rijping (zie uitleg). Rijpe antistoffen binden sterker aan het virus, waardoor steeds minder antistoffen nodig zijn om te voorkomen dat het virus een epitheelcel infecteert. Vier weken na infectie of vaccinatie hebben mensen beschermende antistoffen. Rijping van antistoffen vraagt om virus. Dat kan door een tweede vaccinatie, maar ook in de tijd na infectie (Figuur 3). Een halfjaar na infectie hebben mensen sterkere antistoffen doordat het virus in de patiënt blijft (zie ziekte is meer dan cijfers). Het is nog niet onderzocht of antistoffen na (laat na) infectie sterker of minder sterk zijn dan na vaccinatie. Daarbij moet ook worden gedacht aan de verschillen tussen mensen met een effectieve en een ineffectieve afweerreactie tegen het virus.
Figuur 3. Rijping van antistoffen
Ontsnappen aan afweer
In het begin van mijn wetenschappelijke carrière was ik betrokken bij vaccinonderzoek naar virus escape mutanten. Escape mutanten zijn varianten van het virus die niet meer binden aan een (groepje) antistof(fen). Dat betekent dat die antistoffen nutteloos zijn geworden, maar omdat een virus op verschillende plaatsen (epitopen) herkend wordt door antistoffen is dat niet direct een probleem. Vaak leiden mutaties tot een factor 10 of 100 reductie in sterkte van antistofbinding. Antistoffen die voorheen voldoende goed bonden, binden dan niet meer. Een vergelijk mechanisme, maar iets complexer, bestaat voor virussen die T-cel responsen ontduiken.
Het virus ontsnapt aan neutralisatie door sommige antistoffen door mutaties. De helft van de bloedmonsters toonden aan dat alle neutraliserende activiteit verloren was gegaan. Deze virussen zijn dus escape varianten waarvoor iemand opnieuw gevoelig is. Sterkere antistoffen binden na infectie of na tweede vaccinatie binden nog wel aan gemuteerde virussen. Een enkele virus escape mutant kan ook door de gerijpte antistoffen niet meer geneutraliseerd worden.
Escape varianten is evolutie van virussen (zie voorbeeld evolutie in lab). Belangrijk voor dit proces zijn:
Het virus ontsnapt aan neutralisatie door sommige antistoffen door mutaties. De helft van de bloedmonsters toonden aan dat alle neutraliserende activiteit verloren was gegaan. Deze virussen zijn dus escape varianten waarvoor iemand opnieuw gevoelig is. Sterkere antistoffen binden na infectie of na tweede vaccinatie binden nog wel aan gemuteerde virussen. Een enkele virus escape mutant kan ook door de gerijpte antistoffen niet meer geneutraliseerd worden.
Escape varianten is evolutie van virussen (zie voorbeeld evolutie in lab). Belangrijk voor dit proces zijn:
- Veel virusreproductie doordat veel mensen geïnfecteerd worden. Met wereldwijd meer dan 100 miljoen infecties zijn we daar effectief mee bezig.
- Selectiedruk door mensen met zwakke of gedeeltelijke immuniteit.
- Vaccinatie die niet 100% beschermd tegen infectie – of iemand ziek wordt is voor het ontstaan van escapevarianten niet relevant.
- Mensen met een zwakke afweer.
- Mensen die opnieuw geïnfecteerd worden, nadat hun afweer is verminderd.
Hoelang blijft immuniteit?
Na infectie of vaccinatie zijn de meeste mensen, maar niet iedereen beschermd tegen het SARS-2 virus. Geschat wordt dat na infectie 5 tot 10% niet beschermd is, vergelijkbaar met de beste vaccins. In de klinische studies beschermde de mRNA vaccins van Pfizer en Moderna extreem goed tegen SARS-2 (90-95%). Deze vaccins werken zo goed omdat ze zowel CD4 en CD8 T-cel responsen induceren.
Het adenovirus vector vaccin van AstraZeneca dat 60% bescherming biedt induceert waarschijnlijk een mix van antistoffen en T-cellen. Het is reëel om te verwachten dat de vaccins in een ongecontroleerde setting iets minder effectief zijn, omdat dan nog meer verschillende kwetsbare mensen gevaccineerd worden die niet in de studies betrokken waren.
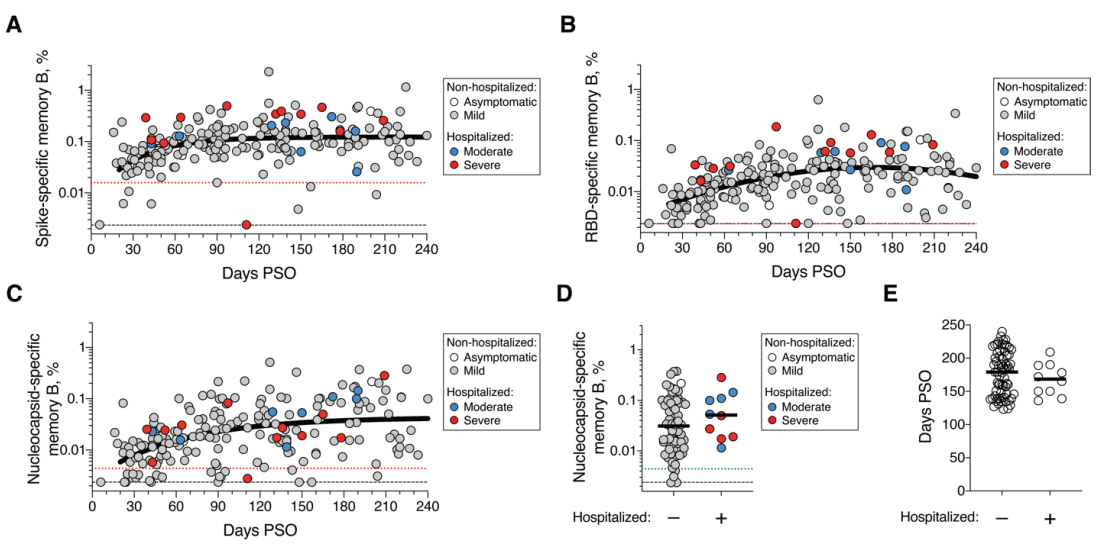
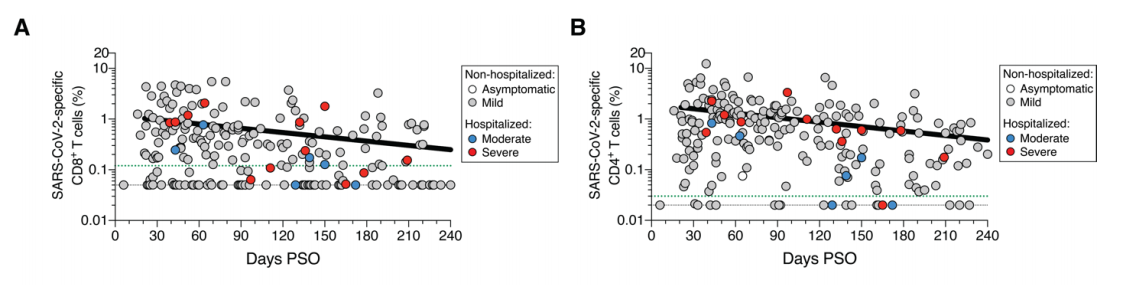
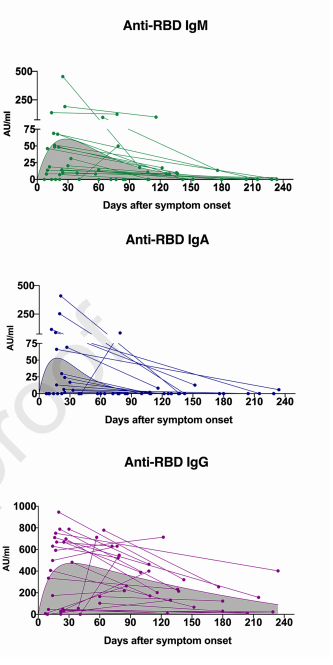
Na infectie blijven IgG antistoffen tegen SARS-2 minimaal vijf maanden (Figuur 1). CD4 en CD8 T-cellen nemen in die tijd een factor 3 en 5 af (Figuur 4). Van de patiënten heeft 90% en 70% CD4 en CD8 na 1 tot 2 maanden, en slechts 75% en 43% na vijf maanden. IgA neemt het sterkste af, 63% heeft dit na 1 tot 2 maanden na infectie, maar slechts 27% na vijf maanden. Dat betekent dat steriliserende immuniteit, nodig voor groepsimmuniteit bij driekwart van de mensen slechts kort blijft bestaan. We weten dat 5% van de ex-patiënten lage afweerresponsen heeft na 6 maanden. Mogelijk zijn dit de mensen die opnieuw geïnfecteerd kunnen worden met een andere stam van hetzelfde virus.
Twee belangrijke kanttekeningen bij de immuniteit. We hebben weinig gegevens over een periode van meer dan 6 tot 9 maanden. Het echte belangrijke gegeven, tot wanneer zijn mensen beschermd, ontbreekt in de studies. In het volgende stukje komen daar een paar aanwijzingen voor.
Het adenovirus vector vaccin van AstraZeneca dat 60% bescherming biedt induceert waarschijnlijk een mix van antistoffen en T-cellen. Het is reëel om te verwachten dat de vaccins in een ongecontroleerde setting iets minder effectief zijn, omdat dan nog meer verschillende kwetsbare mensen gevaccineerd worden die niet in de studies betrokken waren.
Na infectie blijven IgG antistoffen tegen SARS-2 minimaal vijf maanden (Figuur 1). CD4 en CD8 T-cellen nemen in die tijd een factor 3 en 5 af (Figuur 4). Van de patiënten heeft 90% en 70% CD4 en CD8 na 1 tot 2 maanden, en slechts 75% en 43% na vijf maanden. IgA neemt het sterkste af, 63% heeft dit na 1 tot 2 maanden na infectie, maar slechts 27% na vijf maanden. Dat betekent dat steriliserende immuniteit, nodig voor groepsimmuniteit bij driekwart van de mensen slechts kort blijft bestaan. We weten dat 5% van de ex-patiënten lage afweerresponsen heeft na 6 maanden. Mogelijk zijn dit de mensen die opnieuw geïnfecteerd kunnen worden met een andere stam van hetzelfde virus.
Twee belangrijke kanttekeningen bij de immuniteit. We hebben weinig gegevens over een periode van meer dan 6 tot 9 maanden. Het echte belangrijke gegeven, tot wanneer zijn mensen beschermd, ontbreekt in de studies. In het volgende stukje komen daar een paar aanwijzingen voor.
Herinfectie en persistente infectie
Wetenschappers proberen onderscheid te maken tussen herinfecties en persistente infecties. Herinfectie betekent opnieuw geïnfecteerd worden door het virus, persistentie betekent dat het virus zich ergens in het lichaam verstopt. Herinfecties zijn te positief herkennen als het een andere viruslijn betreft. Persistente infecties zijn positief te identificeren doordat het virus in het lichaam blijft. Beide mechanismen zijn aangetoond, maar omdat dit complex is, is het bij veel terugkomende infecties onduidelijk of dit persistentie of een herinfectie is.
Sommige patiënten scheiden vier maanden lang virus RNA uit, vooral na milde infecties in oudere mensen. Bij hoge RNA-concentraties kan ook infectieus virus worden geïsoleerd ondanks neutraliserende antistoffen. Dat betekent niet dat ze besmettelijk hoeven te zijn, want virus dat omgeven is door neutraliserende antistoffen kan makkelijk worden opgeruimd en leidt niet snel tot een infectie. Mensen die suggereren dat RNA dat gedetecteerd wordt in RT-PCR oud RNA is, begrijpen weinig van de stabiliteit van RNA. Voor mijn proefschrift gebruikte ik RNA detectie om aan te tonen dat weefsel levend was. In de moleculaire biologie is al lang bekend dat RNA een stabiliteit van tientallen minuten heeft bij kamertemperatuur en korter bij lichaamstemperatuur. . Het idee dat RNA dagen of weken na het verdwijnen van het virus gedetecteerd kan worden, lijkt op de theepot in de baan rond de zon, beschreven door Russell.
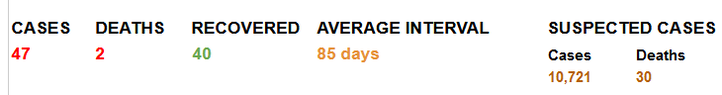
Herinfecties bij coronaverkoudheidsvirussen gebeuren ongeveer eenmaal per jaar. Na ongeveer zes maanden waren de antistofniveaus gedaald. Data van T-cel immuniteit is minder bekend. Casussen van herinfectie van SARS-2 zijn beschreven, zowel symptomatisch na symptomatisch als na asymptomatisch. Herinfecties kunnen ernstig of mild zijn en volgen op ernstige of milder infectie. In 47 bewezen gevallen gaat het om twee doden:
Sommige patiënten scheiden vier maanden lang virus RNA uit, vooral na milde infecties in oudere mensen. Bij hoge RNA-concentraties kan ook infectieus virus worden geïsoleerd ondanks neutraliserende antistoffen. Dat betekent niet dat ze besmettelijk hoeven te zijn, want virus dat omgeven is door neutraliserende antistoffen kan makkelijk worden opgeruimd en leidt niet snel tot een infectie. Mensen die suggereren dat RNA dat gedetecteerd wordt in RT-PCR oud RNA is, begrijpen weinig van de stabiliteit van RNA. Voor mijn proefschrift gebruikte ik RNA detectie om aan te tonen dat weefsel levend was. In de moleculaire biologie is al lang bekend dat RNA een stabiliteit van tientallen minuten heeft bij kamertemperatuur en korter bij lichaamstemperatuur. . Het idee dat RNA dagen of weken na het verdwijnen van het virus gedetecteerd kan worden, lijkt op de theepot in de baan rond de zon, beschreven door Russell.
Herinfecties bij coronaverkoudheidsvirussen gebeuren ongeveer eenmaal per jaar. Na ongeveer zes maanden waren de antistofniveaus gedaald. Data van T-cel immuniteit is minder bekend. Casussen van herinfectie van SARS-2 zijn beschreven, zowel symptomatisch na symptomatisch als na asymptomatisch. Herinfecties kunnen ernstig of mild zijn en volgen op ernstige of milder infectie. In 47 bewezen gevallen gaat het om twee doden:
- Tweemaal eerste infectie ernstig, tweede mild
- Eenmaal eerste infectie ernstig, tweede ernstig
- Zesmaal eerst milde(re) infectie tweede is ernstig.
Figuur 5. Kopregel van herinfecties overzicht. Klik op figuur voor volledige tabel.
Steriliserende en groepsimmuniteit
Luchtweg RNA-virussen zoals influenza, RSV, corona- en rhinovirussen veroorzaken meestal geen steriliserende immuniteit. Steriliserende immuniteit betekent bescherming tegen ziekte en tegen infectie. Niet-steriliserende immuniteit is alleen bescherming tegen de ziekte. Deze luchtwegvirussen weten het afweersysteem te ontduiken om immune mensen te kunnen blijven infecteren zonder dat de immune personen zelf ziek worden. Daardoor kunnen deze immune personen de ziekte doorgeven aan andere mensen.
De meeste niet-luchtwegvirussen veroorzaken wel steriliserende immuniteit. Mensen met steriliserende immuniteit kunnen niet geïnfecteerd worden en verspreiden het virus daardoor niet verder. Dat is de basis van het principe van groepsimmuniteit. Een vereenvoudigd sommetje.
Als SARS-2 vaccinatie steriliserende immuniteit oplevert is de formule voor de grens groepsimmuniteit (HIT):
I * Si >= 1 – 1 / R0
IgA is de antistof die nodig is voor steriliserende immuniteit, maar slechts 78% van de mensen maakt IgA aan na infectie. Daarnaast blijkt dat de meeste mensen na infectie slechts korte IgA produceren, na drie maanden is alles verdwenen (Figuur 6). IgG blijf wel, dus mensen hebben wel antistoffen (en T-cellen) om zichzelf te beschermen tegen ziekte. Zelfs van Dissel verwacht geen steriliserende immuniteit meer na vaccinatie.
Leidt immuniteit per definitie tot minder virusuitstoot? Nee, een studie bij influenza liet het tegenovergesteld zien. Gevaccineerde mensen hadden fijnere druppels en verspreiden juist meer virus. De aanname dat vaccinatie besmetting van luchtwegvirussen voorkomt is gevaarlijk en niet gestoeld op wetenschappelijk bewijs. Besmettelijkheid is een complexe interactie tussen virusproductie en ontstekingsreacties.
Studies in gevaccineerde mensen laten hetzelfde beeld zien voor IgA productie: tijdelijk in de eerste 2 – 3 maanden. Daarnaast helpt type 1 interferon door vaccinatie nog mee in de vroeg fase. De eerste drie maanden na de vaccinatie bestaat er een klein beschermend effect, dat echter erg klein is voor groepsimmuniteit en vervolgens weer verdwijnt. In Manaus zag men iets dergelijks toen heel snel heel veel mensen werden geïnfecteerd, de epidemie nam even af, om daarna op volle snelheid door te gaan.
De meeste niet-luchtwegvirussen veroorzaken wel steriliserende immuniteit. Mensen met steriliserende immuniteit kunnen niet geïnfecteerd worden en verspreiden het virus daardoor niet verder. Dat is de basis van het principe van groepsimmuniteit. Een vereenvoudigd sommetje.
- Indien gemiddeld ⅔ van de contacten van een besmet persoon steriliserende immuniteit heeft, dan is gemiddeld 1 - ⅔ = ⅓ van de mensen vatbaar voor het virus.
- Heeft iemand heeft gemiddeld 3 contacten (R0=3, basis reproductiegetal) dan is de effectieve reproductie (Re) = ⅓ * 3 = 1. Dat is het punt waarbij de besmetting niet verder toe- of afneemt.
- Bij het benaderen van Re=1 neemt de epidemie snelheid sterk af in gelijkblijvende omstandigheden. Dat is een belangrijke aanwijzing dat groepsimmuniteit bijna bereikt is.
Als SARS-2 vaccinatie steriliserende immuniteit oplevert is de formule voor de grens groepsimmuniteit (HIT):
I * Si >= 1 – 1 / R0
- R0 = reproductie getal
- I = % mensen dat immuun is (90- 95%).
- Si = % mensen met steriliserende immuniteit in de immune groep.
IgA is de antistof die nodig is voor steriliserende immuniteit, maar slechts 78% van de mensen maakt IgA aan na infectie. Daarnaast blijkt dat de meeste mensen na infectie slechts korte IgA produceren, na drie maanden is alles verdwenen (Figuur 6). IgG blijf wel, dus mensen hebben wel antistoffen (en T-cellen) om zichzelf te beschermen tegen ziekte. Zelfs van Dissel verwacht geen steriliserende immuniteit meer na vaccinatie.
Leidt immuniteit per definitie tot minder virusuitstoot? Nee, een studie bij influenza liet het tegenovergesteld zien. Gevaccineerde mensen hadden fijnere druppels en verspreiden juist meer virus. De aanname dat vaccinatie besmetting van luchtwegvirussen voorkomt is gevaarlijk en niet gestoeld op wetenschappelijk bewijs. Besmettelijkheid is een complexe interactie tussen virusproductie en ontstekingsreacties.
Studies in gevaccineerde mensen laten hetzelfde beeld zien voor IgA productie: tijdelijk in de eerste 2 – 3 maanden. Daarnaast helpt type 1 interferon door vaccinatie nog mee in de vroeg fase. De eerste drie maanden na de vaccinatie bestaat er een klein beschermend effect, dat echter erg klein is voor groepsimmuniteit en vervolgens weer verdwijnt. In Manaus zag men iets dergelijks toen heel snel heel veel mensen werden geïnfecteerd, de epidemie nam even af, om daarna op volle snelheid door te gaan.
Figuur 6. Verloop IgM, IgG en IgA antistoffen vanaf het begin van de symptomen.
Nieuwe vaccins voor steriliserende immuniteit
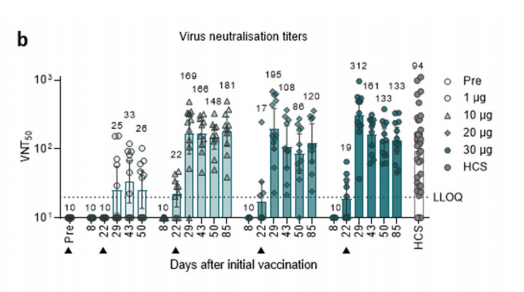
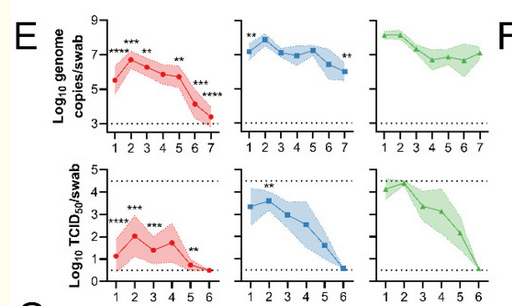
Het primaire doel van vaccinatie is bescherming tegen ziekte, maar groepsimmuniteit zou een mooie en gewenste bijwerking kunnen zijn van vaccinatie. Dan zouden ook mensen die, om welke reden dan ook, niet gevaccineerd (kunnen) worden, een stuk bescherming kunnen krijgen. Naast T-cellen induceren huidige SARS-2-vaccins een IgG-respons, waardoor ziekte wordt voorkomen. Vanwege de afwezigheid van IgA verwacht men geen steriliserende immuniteit. De meeste vaccins tegen luchtweginfecties bieden slechts beperkte bescherming tegen virusreplicatie in de hoge luchtwegen, aangezien dit IgA in het slijmvlies vereist. Daarom doet men onderzoek naar vaccins die wel IgA induceren. De belangrijkste invalshoek is vaccinatie in de neus. Hiervoor worden onder andere adenovector vaccin gebruikt. Deze worden ontwikkeld in China, India en de VS. Een studie met het AstraZeneca vaccin in hamsters laat zien dat vaccinatie in de neus en in de spieren leidt tot antistoffen in de circulatie (Figuur 7), maar alleen vaccinatie in de neus verlaagd de uitstoot van virus (Figuur 8).
Figuur 8. Virustiters na infectie in hamsters die gevaccineerd waren met het AstraZeneca vaccin AZD1222 in de neus (rood) of de spier (blauw) en de controlegroep (groen). De bovenste lijn gaat over RNA kopieën, de onderste over infectieus virus.
Onethisch handelen
Hiermee kom ik terug op de ethische principes die we in Nederland kennen: Gaan we voor het goede? Het Nederlandse beleid suggereert dat we de levens van sommige mensen belangrijker vinden dan die van anderen.
Nederland brak met Europese ethische principes om eerst de kwetsbare mensen te vaccineren. Het kabinet doet hierbij een onterecht beroep op groepsimmuniteit. Beschermen van de zorgmedewerkers is meer gebaat bij goede mondkapjes, iets wat het kabinet tot op heden verzuimd heeft. Nu inzetten op groepsimmuniteit heeft geen wetenschappelijke basis en druist in tegen de ethische adviezen van de Europese geneesmiddelenautoriteit (EMA) en de gezondheidsraad. De laatst de laatste heeft in een ultieme noodroep het kabinet 4x voorzien van hetzelfde advies. Dat doen wetenschappers niet zomaar, want bewijs zou je niet hoeven te herhalen.
Het feit dat ik dat als wetenschapper ook de boodschap herhaal zegt hopelijk genoeg. In Effectief en open strijden had ik het over de toeslagaffaire. Het zou goed zijn daarvoor een parlementaire enquête te houden. Dat zou ook passen bij het Nederlandse COVID-19 beleid. Dan niet alleen vanwege de keuzes op het gebied van vaccinatie; meermaals zijn vraagtekens gezet bij het scheiden wetenschap en politiek, de werkwijze epidemiebestrijding en de integriteit.
Nederland brak met Europese ethische principes om eerst de kwetsbare mensen te vaccineren. Het kabinet doet hierbij een onterecht beroep op groepsimmuniteit. Beschermen van de zorgmedewerkers is meer gebaat bij goede mondkapjes, iets wat het kabinet tot op heden verzuimd heeft. Nu inzetten op groepsimmuniteit heeft geen wetenschappelijke basis en druist in tegen de ethische adviezen van de Europese geneesmiddelenautoriteit (EMA) en de gezondheidsraad. De laatst de laatste heeft in een ultieme noodroep het kabinet 4x voorzien van hetzelfde advies. Dat doen wetenschappers niet zomaar, want bewijs zou je niet hoeven te herhalen.
Het feit dat ik dat als wetenschapper ook de boodschap herhaal zegt hopelijk genoeg. In Effectief en open strijden had ik het over de toeslagaffaire. Het zou goed zijn daarvoor een parlementaire enquête te houden. Dat zou ook passen bij het Nederlandse COVID-19 beleid. Dan niet alleen vanwege de keuzes op het gebied van vaccinatie; meermaals zijn vraagtekens gezet bij het scheiden wetenschap en politiek, de werkwijze epidemiebestrijding en de integriteit.