John Jacobs, 2 oktober 2003
Antibiotica hebben de mens geholpen om bacteriële infecties te controleren. Virus-infecties, zoals AIDS, griep, SARS, herpes, Ebola en Mond- en klauwzeer kunnen echter nauwelijks bestreden worden. Virussen moeten cellen infecteren om zich te vermenigvuldigen, waardoor deze gastheercellen ziek worden en eventueel doodgaan. De gastheer verdedigt zich hier tegen met een afweerreactie, die de virussen op hun manier weer proberen te ontduiken. Dit gebeurt op twee hoofdmanieren: via een standaard strategie gecodeerd in het erfelijk materiaal van het virus of doordat het virus zichzelf blijft veranderen.
Virussen kunnen zich niet zelfstandig vermenigvuldigen. Hiervoor hebben ze de hulp van gastheercellen nodig. Dat betekent dat virussen cellen moeten infecteren, binnendringen voor hun eigen voortplanting. Een gevolg van die infectie is dat de geïnfecteerde cel ziek wordt en eventueel dood gaat. Dit wil de gastheer niet, dus die zal zich gaan verdedigen met een afweerreactie tegen het virus.
Virussen en ontsnappingsstrategieën
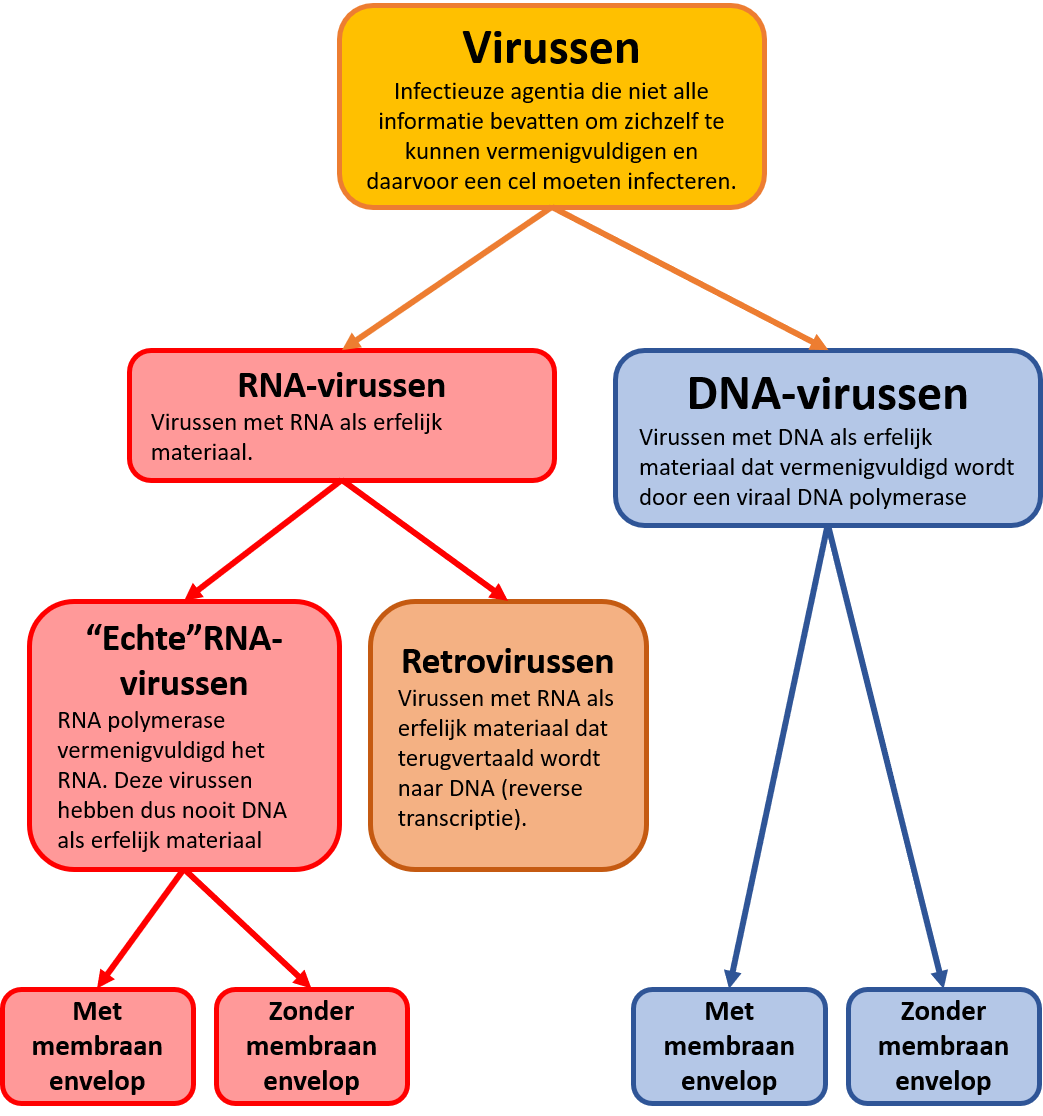
DNA is het erfelijk materiaal (genoom) van alle levende organismen en RNA is de werkkopie waarmee eiwitten worden gemaakt. Bij virussen ligt dit soms echter anders. Één hoofdgroep van virussen heeft DNA als genoom net zoals de cellen van bacteriën, gisten, planten en dieren. De andere hoofdgroep heeft echter RNA als genoom. Binnen deze hoofdgroep bestaan twee voortplantingsstrategieën: ‘gewone’ RNA-virussen die gebruik maken van een enzym om RNA te vermenigvuldigen en retrovirussen die een enzym hebben dat RNA terugvertaalt in DNA. Beide enzymen komen niet voor in cellen en zijn dus uniek voor deze virussen.
Alle virussen, dus DNA, RNA en retrovirussen maken hun eiwitten gewoon door de cel het virale RNA af te laten lezen. Veel virussen maken handig gebruik van het afweersysteem om zich te verspreiden door het lichaam en zo hun favoriete cel op te zoeken. Ondertussen wordt het afweersysteem geactiveerd om het virus op te ruimen. Het specifieke afweersysteem wordt gestuurd door T-helper cellen die B-cellen aanzetten tot het maken van antistoffen of de ontwikkeling van celdodende T-cellen stimuleren. Voor de bestrijding van sommige virussen is één van beide afdoende, maar vaak zijn beide noodzakelijk omdat ze een verschillende strategie hebben. Antistoffen vallen voornamelijk de virussen zelf aan, terwijl celdodende T-cellen de geïnfecteerde cellen doden. De beide type T-cellen en de antistoffen van het specifieke afweersysteem stimuleren het aspecifieke afweersysteem dat bestaat uit het complement systeem en de verschillende bloed cellen. Maar virussen hebben talloze verschillende strategieën ontwikkeld om te voorkomen dat het afweersysteem ze om zeep helpt. Deze strategieën kun je indelen in twee hoofdstrategieën: de vaste strategieën en de strategie van verandering van je erfelijk materiaal.
Afb.1: classificatie van virussen.
De indeling van virussen op grond van hun biologische eigenschappen (erfelijk materiaal (RNA of DNA), de vermeerdering van RNA en het wel/niet hebben van een lipide envelop).
De indeling van virussen op grond van hun biologische eigenschappen (erfelijk materiaal (RNA of DNA), de vermeerdering van RNA en het wel/niet hebben van een lipide envelop).
Het afweersysteem verspreidt virussen
Ironisch genoeg verspreiden nogal wat virussen zich door het lichaam door gebruik te maken van het afweersysteem. De meeste virussen komen het lichaam binnen via huid, longen en luchtwegen, het maag-darm kanaal of via de geslachtsorganen. Deze weefsels hebben contact met de buitenwereld en bevatten daarom veel cellen van het afweersysteem (met name dendritische cellen die het afweersysteem aanzetten). Als een virus een weefsel infecteert, migreert de dendritische cel van zijn weefsel (bijvoorbeeld de huid) naar de afvoerende lymfeknoop. Veel virussen infecteren die dendritische cel en gaan zodoende mee naar de afvoerende lymfeknoop waar de afweerreactie op gang komt, maar waar ook virusdeeltjes worden geproduceerd. Aangezien de virusproductie sneller gaat dan het ontstaan van een afweerreactie, komt het virus vanuit de lymfeknoop in het bloed. Via het bloed komt het virus dan bij zijn doelorgaan, wat afhankelijk is van het virus en waar het ziektebeeld optreedt. Sommige virussen komen direct na besmetting in hun doelorgaan terecht. In het geval van het AIDS-virus gaat het virus zelfs weer terug naar de lymfeknopen en herhaalt de vermenigvuldiging zich daar.
Een opmerkelijk virus in deze groep is het muizen borstkanker virus (MMTV; mouse mammary tumor virus). Muizen raken besmet met dit virus via de borstvoeding. De borstvoeding en MMTV komen in de darmen terecht en daar worden B-cellen geïnfecteerd, die daar klaarliggen om antistoffen te maken bijvoorbeeld tegen darmbacteriën. Het virus zorgt voor de activatie en de deling van die B-cellen, die vervolgens door het lichaam gaan zwerven, en in het borstweefsel terechtkomen. In het borstweefsel infecteert MMTV de melkkliercellen, om vervolgens via de melk te worden uitgescheiden.
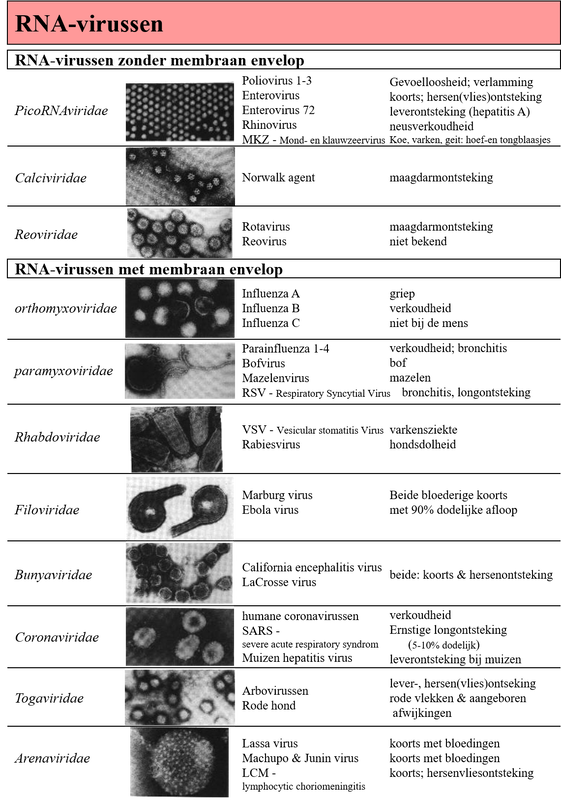
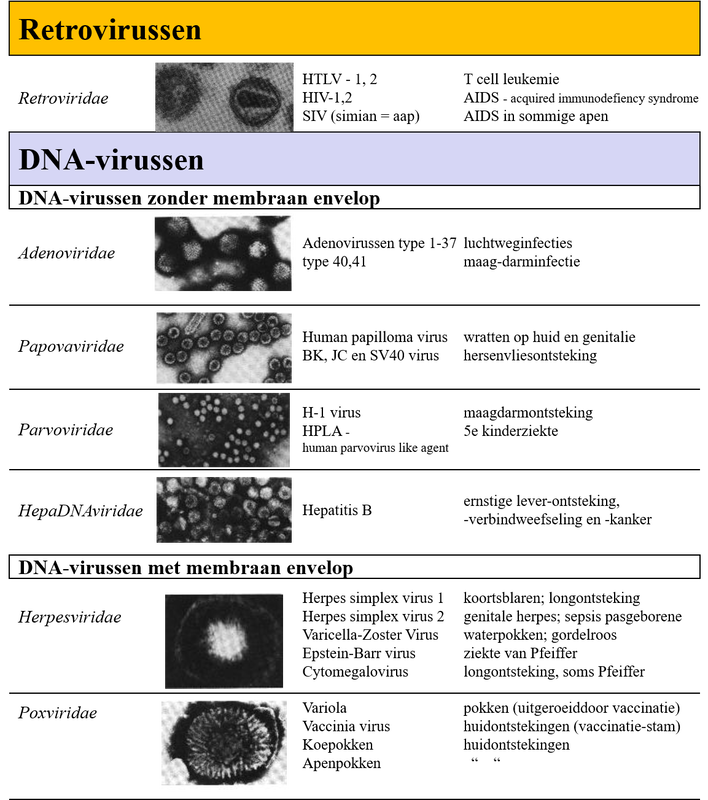
Afb. 2a & 2b: Virussen en hun ziekte
I. Virusgroepen volgens hun classificatie met een elektronen microscopische foto, enkele bekende ziekteverwekkers behorend tot die virus-groep, en de ziektes veroorzaakt door deze ziekteverwekkers.
I. Virusgroepen volgens hun classificatie met een elektronen microscopische foto, enkele bekende ziekteverwekkers behorend tot die virus-groep, en de ziektes veroorzaakt door deze ziekteverwekkers.
Vaste ontduikingsstrategieën
De vaste strategieën liggen opgeslagen in het erfelijk materiaal van de virussen. Je kunt hierbij denken aan
(1) communicatie verstoring in het afweersysteem,
(2) blokkeren afweerreacties
(3) het maken van blinderingeiwitten zodat de geïnfecteerde cel niet herkend wordt,
(4) virussen die zich verstoppen in de cel zonder dat virale eiwitten worden gemaakt, en
(5) ‘hit and run’ strategie.
Deze strategieën worden gebruikt door zowel virussen met een DNA als RNA-genoom, maar de eerste drie zijn vooral bekend van DNA-virussen.
(1) communicatie verstoring in het afweersysteem,
(2) blokkeren afweerreacties
(3) het maken van blinderingeiwitten zodat de geïnfecteerde cel niet herkend wordt,
(4) virussen die zich verstoppen in de cel zonder dat virale eiwitten worden gemaakt, en
(5) ‘hit and run’ strategie.
Deze strategieën worden gebruikt door zowel virussen met een DNA als RNA-genoom, maar de eerste drie zijn vooral bekend van DNA-virussen.
Communicatie verstoring
De cellen van het afweersysteem communiceren met elkaar via eiwitten, cytokines genaamd, en door elkaar direct te herkennen met behulp van receptoren (herkenningsmoleculen). Verschillende cytokines vertellen de afweercellen waar ze naar toe moeten gaan, of ze wel of niet moeten aanvallen, welke type cellen ze moeten aanvallen en hoe sterk die aanval moet zijn. Met het toenemen van de ontsteking wordt de roep om aanvallen steeds sterker, maar bij het beëindigen van de ontsteking steeds zwakker. Daar waar de communicatie door cytokines gebeurt, kan een virus die communicatie verstoren door andere cytokines te maken, of eiwitten die heel veel op cytokines lijken. Deze virale eiwitten doen dan hetzelfde als de cytokines, of remmen juist de cytokines waardoor de afweer verstoord wordt. Deze strategie wordt uitgevoerd door onder andere het pokkenvirussen, Epstein-Barr virus en cytomegalovirus (de laatste 2 virussen veroorzaken de ziekte van Pfeiffer en een vergelijkbaar ziektebeeld).
Blokkering afweerreactie
Een andere strategie is het blokkeren van cel – cel binding door de receptoren voor die aanhechting te blokkeren. Deze strategie wordt onder andere gebruikt door het Epstein-Barr virus. Het mazelen-virus blokkeert de eerste activatie van de afweerreactie (de dendritische cellen) en daardoor de communicatie in het afweersysteem. Verstoring van cel – cel communicatie werkt goed tegen afweerreacties uitgevoerd door cellen, maar antistoffen en het complementsysteem kunnen gewoon hun werk doen. Het complement systeem is een groep eiwitten die elkaar activeren, nadat de eerste is geactiveerd volgen de anderen, en uiteindelijk leidt activatie van het complement systeem tot onder andere het stuk maken (lyseren) van cellen in de omgeving. Het complement systeem kan worden geactiveerd door antistoffen, maar ook direct door zieke cellen. Daarom hebben herpesvirussen eiwitten die antistoffen wegvangen en ook eiwitten die het complement wegvangen. Een andere manier om de afweerreactie te blokkeren is de afweercellen te infecteren. Het Epstein-Barr virus infecteert B-cellen en beïnvloedt daarmee de antistof productie; het AIDS-virus infecteert T-helper cellen en ontregelt daarmee de aansturing van het afweersysteem door T-helper cellen.
Blindering van de cel
Het afweersysteem is speciaal toegerust voor de bescherming tegen virussen met MHC I (major histocompatibility complex moleculen van klasse I). MHC I is een eiwit dat van alle eiwitten in de cel kleine stukjes (peptiden) laat zien. Deze peptiden worden door een ander eiwit gemaakt. De MHC I moleculen die vrijwel elke cel laat zien kunnen worden herkend door celdodende (cytotoxische) T-cellen. Het afweersysteem maakt verschillende celdodende T-cellen willekeurig aan die vervolgens in de thymus geselecteerd worden op het vermogen een MHC I met een lichaamsvreemd peptide te onderscheiden van een MHC I met peptiden van het eigen lichaam. Zodoende krijg je dus een grote verzameling van allemaal verschillende celdodende T-cellen die MHC I herkennen met een vreemd peptide erin. Als zo’n celdodende T-cel de geïnfecteerde cel herkent dan wordt deze gedood. De dood van zijn gastheercel betekent voor een virus dat deze zich niet meer kan vermenigvuldigen.
Herpes simplex virussen 1 en 2, bekend van de koortsblaren en de blaasjes op de geslachtsorganen, hebben hier wat op gevonden: ze blokkeren het eiwit dat peptiden maakt om te laten zien dat de cel geïnfecteerd is. Daardoor wordt de cel niet herkend als een door herpes geïnfecteerde cel. Het MHC I is echter zo gemaakt dat het niet naar buiten komt als er geen peptide in zit, dus indirect blokkeert het herpesvirus het MHC I. Maar het afweersysteem heeft gelukkig nog een wapen achter de hand namelijk de natural killer (NK) cellen. De NK-cellen (van nature dodende cellen) herkennen en doden cellen waar geen deugdelijk MHC I peptide op zit. Minstens één herpesvirus, cytomegalovirus, heeft helaas ook daar wat opgevonden; cytomegalovirus maakt een eiwit dat lijkt op MHC I, waardoor de NK-cellen ‘gerustgesteld’ worden en de geïnfecteerde cel niet doden.
Verstoppertje
Cellen laten dus van alle eiwitten die ze maken kleine stukjes zien, peptiden, die door het MHC I worden gepresenteerd aan de buitenkant van de cel. Zodoende is een geïnfecteerde cel dus te herkennen aan de virus-peptiden die door het MHC I worden gepresenteerd. Als een virus geen of nauwelijks eiwitten maakt wordt de cel echter niet herkend als een geïnfecteerde cel. Het virus kan zich dan weliswaar ook niet vermenigvuldigen en moet een gunstiger moment afwachten. Deze periode heet latente infectie. Het virus wordt geactiveerd als het afweersysteem van de patiënt minder goed werkt, of minder goed werkt op de plaats waar het virus zich wil voortplanten. Deze strategie wordt gevolgd door onder andere het Varicella Zoster Virus, bekent van de kinderziekte waterpokken. Nadat je de waterpokken hebt gehad verstopt het virus zich in het zenuwstelsel in je ruggenmerg. Als je afweer vermindert, bijvoorbeeld bij oudere mensen, dan kan het virus vanuit het zenuwstelsel in gordels evenwijdig aan je ribben terug komen in de vorm van gordelroos. Hetzelfde principe wordt ook gebruikt door Herpes simplex virus 1; koortsblaren ontstaan na lokale onderdrukking van het afweersysteem door bijvoorbeeld UV-licht. Recent onderzoek laat zien dat het AIDS-virus in geval van succesvolle therapie zich ook latent verschuilt in het lichaam.
Het gevolg van vaste ontduikingsstrategieën
Doordat virussen een ontduikingsstrategie hebben worden ze niet zo snel opgeruimd in het lichaam; in het geval van latentie (verstoppertje) wordt het virus zelfs nog helemaal niet opgeruimd. Na verloop van tijd wordt de afweerreactie sterker, en wint het lichaam de strijd van het virus vrijwel altijd. Doordat de strijd langer duurt heeft het virus echter meer tijd om de volgende persoon te besmetten. Is iemand echter geïnfecteerd door een virus dat de communicatie van het afweersysteem verstoort dan is die persoon gevoeliger voor een tweede infectie met bacteriën of virussen. Deze tweede infectie kan daardoor een veel ernstiger verloop hebben. Ook mensen met een verminderde afweer kunnen gevaarlijke ziektes krijgen van virussen die het goed werkende deel van hun afweersysteem ontduiken.
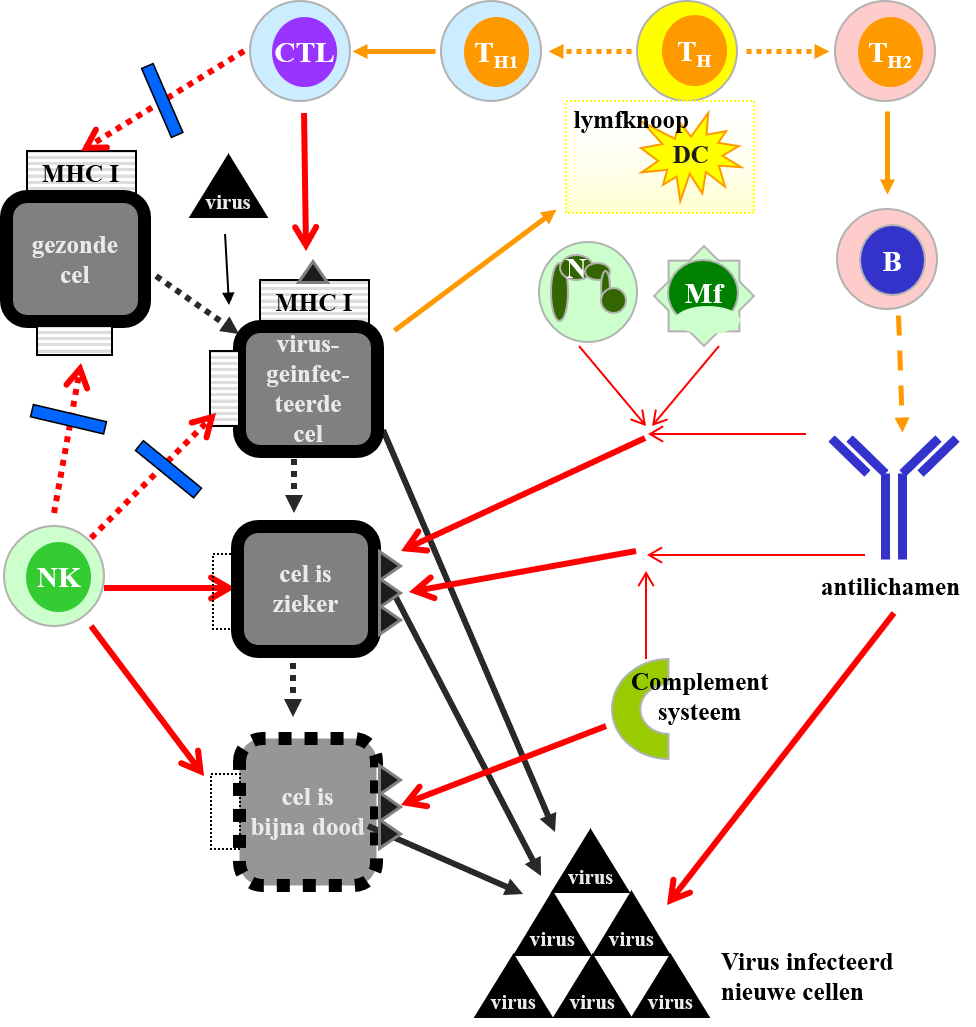
Afb. 3: Interacties tussen virussen en het afweersysteem.
Aangegeven pijlen: De zwarte lijnen geven de veranderingen van de (virusgeïnfecteerde) cel weer en de virusproductie door de geïnfecteerde cel. De oranje lijnen geven de ontwikkeling van de anti-virus afweerreactie aan. De rode lijnen met pijlpunten geven de dodelijke acties van het afweersysteem tegen het virus of geïnfecteerde cellen aan. De onderbroken rode lijnen geven met blauwe balken aan dat een dodelijke actie geblokkeerd is. De dunne rode lijnen geven aan dat samenwerking met een ander mechanisme noodzakelijk is voor celdoding.
Aangegeven pijlen: De zwarte lijnen geven de veranderingen van de (virusgeïnfecteerde) cel weer en de virusproductie door de geïnfecteerde cel. De oranje lijnen geven de ontwikkeling van de anti-virus afweerreactie aan. De rode lijnen met pijlpunten geven de dodelijke acties van het afweersysteem tegen het virus of geïnfecteerde cellen aan. De onderbroken rode lijnen geven met blauwe balken aan dat een dodelijke actie geblokkeerd is. De dunne rode lijnen geven aan dat samenwerking met een ander mechanisme noodzakelijk is voor celdoding.
Strategie van verandering
De bovengenoemde ontduikingstrategie ligt opgeslagen in het genoom (erfelijke materiaal) van het virus, maar juist bij de strategie van verandering dient het virus-genoom zo variabel mogelijk te zijn. De strategie van verandering wordt dan ook vooral gebruikt door beide groepen RNA-virussen en veel minder door DNA-virussen. Bij deze strategie dien je als virus tijdens de vermenigvuldiging veel foutjes te maken in je genoom. Zowel het enzym om RNA te vermenigvuldigen als het enzym dat RNA terugvertaalt naar DNA, maken vele fouten. Hierdoor zitten in vrijwel elke kopie andere fouten en zodoende zijn alle virusdeeltjes verschillend. Indien een virus heel veel (miljoenen) varianten maakt, zullen er varianten bij zitten die voordelen bieden. Sommige varianten binden niet aan de bestaande antistoffen, ontduiken de cellulaire afweer of maken het virus ongevoelig voor therapie.
Ontduiken van antistoffen
Dit is voor het eerst beschreven voor de allerkleinste virussen, de picoRNA-virussen, zoals Mond- en Klauwzeervirus. Dit virus is zo klein dat het slechts een beperkt aantal herkenningsstructuren (epitopen) voor antistoffen heeft. Door in het lab, het virus iedere keer met één antistof tegelijkertijd te kweken, ontstaat naar verloop van tijd (minder dan een week) een virus met een andere epitoop die niet herkend wordt door deze ene antistof. Terwijl virussen die lijken op het ‘moedervirus’ zich moeilijk kunnen handhaven in de aanwezigheid van antistoffen kan juist deze variant zich onbeperkt vermenigvuldigen. Zo krijg je op den duur allemaal virusvarianten die allemaal ongevoelig zijn voor deze ene antistof. Als dit virus vervolgens gekweekt wordt met een antistof dat een andere epitoop herkent, ontstaat op gelijke wijze een virus dat door twee verschillende antistoffen op twee epitopen niet herkend wordt. Door dit te blijven herhalen, werd ontdekt dat een virus met vijf veranderde epitopen in het geheel niet meer gevoelig is voor de antistoffen van een dier dat immuun was voor het virus met de vijf originele epitopen. Het afweersysteem moet dan van voor af aan beginnen met het ontwikkelen van een afweerreactie. Bij chronische infecties in de patiënt leidt dit tot het ontstaan van virus mutanten die niet herkend worden door de aanwezige antilichamen. Daarop maakt het lichaam nieuwe antilichamen, waarop het virus wederom muteert. Deze strategie is later ook ontdekt bij vele andere RNA-virussen, waaronder het AIDS-virus. Het AIDS-virus kent hierbij nog een speciaal trucje: een beweegbaar gedeelte van het eiwit dat het AIDS-virus gebruikt om cellen binnen te komen wordt naar binnen gebracht om niet herkend te worden door antistoffen. Op het moment van het aanraken van een cel komt deze structuur dan even naar buiten om de cel te kunnen infecteren. Omdat dit gedeelte zo kort beschikbaar is voor antistoffen worden maar weinig AIDS-virusdeeltjes opgeruimd door antistoffen.
Ontduiken van de celdodende T-cellen
Naast antistoffen, maakt het lichaam ook celdodende T-cellen om de infectie te bestrijden. Antistoffen vallen vooral de virusdeeltjes aan, terwijl celdodende T-cellen de geïnfecteerde cellen doden. Bij het doden van de geïnfecteerde cellen worden meestal ook de virussen in die cel gedood. Er zijn veel minder geïnfecteerde cellen dan virusdeeltjes, want elke geïnfecteerde cel maakt er duizenden of miljoenen. Die hoge aantallen verschillende virusdeeltjes zijn nodig om voldoende varianten te krijgen zodat ook de antistof ongevoelige varianten zouden ontstaan. Het is dus niet vanzelfsprekend dat een virus dat voldoende varianten maakt om antistoffen te ontduiken ook voldoende varianten maakt die in geïnfecteerde cellen de celdodende T-cellen kunnen ontduiken. In geval van AIDS worden miljoenen cellen geïnfecteerd door allemaal verschillende varianten van het AIDS-virus. Daar zitten ook varianten bij die eiwitten maken die minder goed of niet herkend worden door de cellulaire afweer. Die varianten hebben dan het selectievoordeel dat ze langer een cel kunnen infecteren en meer virusdeeltjes kunnen maken. Tijdens het voortschrijden van AIDS weet het virus zich op deze manier te handhaven in het lichaam dat steeds nieuwe celdodende T-cellen moet maken omdat het virus daarvoor ongevoelig is. Op den duur (vaak na jaren) wordt de afweer van het lichaam zwakker omdat de T-cellen geïnfecteerd worden door het AIDS-virus en sterven. Dit kan naar een jaar of tien leiden tot de ziekte AIDS met dodelijke afloop.
Ontduiken van de therapie
De strategie van verandering biedt virussen ook een bescherming tegen therapie. Antivirale middelen grijpen aan op een punt in de vermeerdering van het virus. Het virus maakt vele varianten waaronder ook varianten die minder gevoelig zijn voor die antivirale middelen. Deze zullen beter vermeerderen dan de gevoelige varianten en zo ontstaat geleidelijk een groep virus varianten die allemaal ongevoelig zijn voor het ene geneesmiddel (bijvoorbeeld een reverse transcriptase-remmer, een remmer van het enzym dat RNA terugvertaalt in DNA). Dit is het geval binnen vier weken na het starten van een therapie tegen AIDS met één geneesmiddel. Als daarna een tweede geneesmiddel wordt gegeven, wordt het AIDS-virus ook zeer snel ongevoelig voor dit tweede middel. Op den duur leidt dit tot de onbehandelbaarheid van de ziekte. De verschillende antivirale middelen werken op verschillende manieren om de vermeerdering van het AIDS-virus te stoppen (bijvoorbeeld een protease-remmer en een reverse transcriptase-remmer).
Stop de ontsnappingspogingen
De snelle evolutie van ‘gewone’ RNA-virussen en retrovirussen maakt dat er voldoende varianten zijn om een variant te hebben die ongevoelig is voor een antistof, een celdodende T-cel of een antiviraal middel. De combinatie van de hoge aantallen verschillende virusdeeltjes enerzijds en de beperkte druk om anders te zijn voor één antistof, één celdodende T-cel of één antiviraal middel maakt dat al snel ongevoelige virus-varianten ontstaan. Toen men hier aan ging rekenen besefte men dat het een rekenkundige zekerheid is dat therapie ongevoelige varianten evolueren als AIDS behandelt wordt met slechts één geneesmiddel tegelijkertijd. Om dit te doorbreken moet men zorgen dat als die ongevoelige variant ontstaat deze uitgeschakeld wordt door een ander geneesmiddel. Die berekeningen wezen uit dat voor een goede behandeling van AIDS meerdere antivirale middelen tegelijkertijd moesten worden toegediend, zodat geen ongevoelige virussen zouden ontstaan. Uiteindelijk zijn drie verschillend werkende antivirale middelen gecombineerd in de Highly Active Anti-retroviral therapie (HAART; sterk actieve anti-retrovirale therapie). Sinds ongeveer 1997 wordt deze HAART toegepast en vooralsnog ontstaan er weinig therapie ongevoelige varianten van het AIDS-virus. Hieruit mag je concluderen dat HAART redelijk goed werkt om AIDS te stoppen.
Verandering diersoort doet infecteren
Varianten van virussen die evolueren kunnen niet alleen uitgeselecteerd worden omdat ze ongevoelig zijn voor het afweersysteem of therapie, maar ook omdat ze een andere diersoort kunnen infecteren. Deze varianten krijgen met een nieuwe gastheer een nieuwe mogelijkheid om zich te vermenigvuldigen. Virussen die van een diersoort naar de mens kunnen overspringen worden zoönose genoemd. Meestal mislukt de overstap van het ene naar het andere dier, maar af en toe lukt het een virus variant om de soortbarrière te doorbreken. Helaas gaat dit in het begin vaak gepaard met ernstige ziekte en soms een hoog sterftecijfer. Voor een virus is het eigenlijk ongunstig als de gastheer snel doodgaat, omdat een virus een levende gastheer nodig heeft voor zijn voortplanting en de verspreiding naar een nieuwe gastheer. De kans op besmetting van een nieuwe patiënt wordt dus erg klein als het virus snel dodelijk is. Daarom stoppen deze epidemieën oftewel redelijk snel vanzelf, of ze worden minder (snel) dodelijk. Het bekendste voorbeeld van virussen die van diersoort veranderen is de griep, influenza, of vogelpest genoemd bij de gevederde dieren. Terwijl vrijwel de gehele wereldbevolking immuun (ongevoelig door een goede afweer) is tegen de griepvariant van het vorig jaar kan er een nieuwe griep variant in vogels ontstaan, meestal met het varken als tussengastheer. Opnieuw worden vele mensen ziek; onder oude van dagen, hart- en longpatiënten is het sterftecijfer hoog. Een ander voorbeeld is het AIDS-virus (HIV; human immunodeficiency virus) dat afkomstig is van een soortgelijk virus bij apen genaamd SIV (s = simian = aap). SIV lijkt vooral op de minst voorkomende variant van het AIDS-virus, HIV-2, dat nauwelijks buiten West-Afrika is verspreidt.
Extreme sterftecijfers ontstaan als virussen zoals het Marburg virus en Ebola van (mogelijk) apen overspringen op de mens; aan deze bloederige koorts overlijdt 90% van de slachtoffers binnen enkele dagen. Toch zijn deze virussen meestal geen bedreiging voor de wereldvolksgezondheid, omdat ze door hun snelle doden zelden langdurig als epidemie woekeren. Alleen als zo’n virus in een gebied met een hoge bevolkingsdichtheid komt waar besmette mensen veelvuldig met nog niet besmette personen in contact komen zou het virus zich kunnen handhaven. Bij deze ziekten zijn de patiënten echter vaak zo ziek dat ze minder contact met niet-geïnfecteerde mensen hebben. Toch is een (snelle) isolatie van het getroffen gebied dan nodig om verder uitbreiding te kunnen voorkomen. Isolatie van besmette patiënten is ook gedaan bij het coronavirus dat SARS ( Severe Acute Respiratory Syndrome; ernstig acuut ademhalingssymdroom) veroorzaakt en verre familie van de verkoudheidsvirussen is. Waarschijnlijk is ook dit – voorheen onbekende – virus overgesprongen van een nog onbekende diersoort. De sterfte aan SARS (5 – 10%) is niet zo hoog dat dit de verspreiding van het virus remt en de patiënten leven in het algemeen lang genoeg om anderen te besmetten. Door patiënten te isoleren voorkomt men verdere besmetting.
Ook in de toekomst zullen RNA en retrovirussen evolueren en overspringen van de ene soort op de andere soort. Het is niet ondenkbaar dat daar ook weer virussen tussen zitten die vele slachtoffers onder de mens maken. Het blijft dus een noodzaak waakzaam te zijn voor nieuwe virussen.
John Jacobs
Virussen. Zie ook:
- De oorsprong van AIDS (Kennislinkartikel)
- Griep op wereldtournee (Kennislinkartikel)
- Virus X ligt op de loer (Kennislinkartikel)
- Ten aanval: het virus te lijf (Kennislinkartikel)
- Tumor immunologie: je afweersysteem vecht tegen kanker (Kennislinkartikel)
- Transplantatie, auto-immuunziekten en de overleving van de mens (Kennislinkartikel)
- Veiligheid voor de huid zonder dierenleed (Kennislinkartikel)

Dit artikel is geschreven door John Jacobs in samenwerking met het NIBI, Nederlands Instituut voor Biologie.
Publicatie